- Triradikal
-
Als Radikale bezeichnet man Atome oder Moleküle mit mindestens einem ungepaarten Elektron, die meist besonders reaktionsfreudig sind. Radikale werden mit einem 'Punkt' dargestellt, z. B. Stickstoffmonoxid (NO•), der das freie Elektron symbolisiert. Enthält ein Radikal mehrere ungepaarte Elektronen, spricht man von Diradikal (auch Biradikal), Triradikal usw. Radikale spielen eine wichtige Rolle bei bestimmten Oxidationsprozessen, bei Polymerisationen und bei manchen Substitutionsreaktionen.
Inhaltsverzeichnis
Reaktive Radikale
Da die meisten Radikale exergonisch reagieren, sind sie sehr reaktiv und dadurch auch kurzlebig (< 1 Sekunde). Das ungepaarte Elektron befindet sich dabei gewöhnlich an C- , N-, O- und Hg-Atomen oder Halogenen.
Unreaktive Radikale
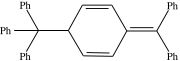
Es sind auch Radikale bekannt, die nicht sofort weiterreagieren und über einen gewissen Zeitraum teilweise sogar als isolierbare Stoffe vorliegen. Ein Beispiel für diese „stabilen Radikale“ ist das Triphenylmethylradikal (Gomberg-Radikal). Wie andere unreaktive Radikale steht es mit seinem Dimer in Lösung im Gleichgewicht. Das Dimer des Gomberg-Radikals ist nicht Hexaphenylethan, wie oftmals angenommen wird, sondern die in der Abb. gezeigte Verbindung. Faktoren, die zu stabilen Radikalen führen, sind zum einen eine Resonanzstabilisierung des Radikals, zum anderen eine Hinderung der Dimerisierung, beispielsweise durch sterisch anspruchsvolle Substituenten. Auch in der Natur kommen stabile Radikale vor. So beinhaltet zum Beispiel das Enzym Ribonukleotidreduktase ein Tyrosylradikal mit einer Halbwertszeit von 4 Tagen.
Stabilität von C-Radikalen
C-zentrierte Radikale zeigen eine zunehmende Stabilität in der Reihe primäres C-Atom < sekundäres C-Atom < tertiäres C-Atom, was durch induktive Effekte und Hyperkonjugation bedingt ist. Außerdem sind sp³-hybridisierte Kohlenstoff-Radikale stabiler als Radikalzentren, in denen der Kohlenstoff eine sp²- oder sp-Hybridisierung aufweist. Auch Aryl- oder Allylgruppen stabilisieren das Radikal.
Bekannte Beispiele
- Disauerstoff O2 - das Sauerstoffmolekül enthält zwei ungepaarte Elektronen (Biradikal •O-O•; die Lewis-Formel O=O gibt die Bindungssituation also nicht komplett wieder) und bildet sich im Magnetfeld als paramagnetisches Triplett ab. Allerdings ist die Reaktionsfähigkeit dieses Biradikals beschränkt, da das Prinzip von der Erhaltung des Spins bei chemischen Reaktionen in den meisten Fällen zuerst eine Anregung zu Singulett-Sauerstoff erfordert.
- Stickstoffmonoxid •NO – ein als Botenstoff erkanntes Molekül mit einem ungepaarten Elektron
- Hydroxyl-Radikal •OH – das reaktivste und bedeutendste Radikal in der Atmosphäre (wichtig für Abbau von Luftverunreinigungen)
- Chlorradikale Cl•- werden durch Lichteinwirkung aus Fluorchlorkohlenwasserstoffen freigesetzt und sind beteiligt an der Zerstörung der Ozonschicht
Entstehung
Radikale entstehen im Körper durch Überlastung der Verbrennungsprozesse in Mitochondrien oder durch extreme äußere Einflüsse:
- extreme Hitze (Feuer)
- UV-Strahlung bewirkt die homolytische Spaltung einer kovalenten Bindung, etwa der Bindung zwischen den beiden Chloratomen von elementarem Chlor unter Bildung von zwei Chlorradikalen
- Röntgen- und andere ionisierende Strahlung
- Zigarettenrauch
Radikale können in den Körper gelangen, indem einer der obigen Einflüsse von außen Moleküle des Körpers in freie Radikale zerteilt. Direkte Einwirkung extremer Hitze ist hier unwichtig, weil der sonstige Schaden durch Feuer viel größer ist. Radikale gelangen durch Essen und Trinken von Nahrung, die ionisierender Strahlung ausgesetzt war, oder durch das Einatmen von Zigarettenrauch in den Körper. Aber auch einige Typen von Lymphozyten produzieren Radikale zur Keimabwehr.
Radikale in der Biologie
Radikale, etwa reaktive Sauerstoffspezies, spielen bei einer Vielzahl biologischer Prozesse eine wichtige Rolle, können aber auch Zellschäden hervorrufen, die u. a. zur Entstehung von Krebserkrankungen beitragen können. Auch für die Entstehung der Arteriosklerose, der Alzheimerschen Krankheit, der Leberschädigung durch Alkohol und des Lungenemphysems durch Zigarettenrauch wird der durch freie Radikale vermittelten Oxidation verschiedener Stoffe eine bedeutsame Rolle zugeschrieben. Unter den intrazellulären Signalwegen, die durch freie Radikale aktiviert werden, ist der NF-κB-Signalweg einer der wichtigsten.
Da der Schutz vor der Wirkung der Radikale lebensnotwendig ist, besitzt der Körper wirksame Abwehr- und Reparaturmechanismen in Form von Enzymen, Hormonen oder anderen Substanzklassen, die den Schaden minimieren. An diesen Abwehrmechanismen sind Antioxidantien wie Epigallocatechingallat, Superoxiddismutase, Glutathionperoxidase, Vitamin A, Vitamin C, Vitamin E, Coenzym Q10 und Anthocyane beteiligt. Auch Bilirubin, Harnsäure sollen bestimmte freie Radikale neutralisieren können. Das Hormon Melatonin gilt ebenfalls als Radikalenfänger gegen den oxidativen Stress. Das stärkste bekannte Antioxidans, das Hydridion H-, spielt z.B. im Citratzyklus und bei vielen Redoxreaktionen des Stoffwechsels eine wichtige Rolle.
Radikale spielen im Rahmen der sogenannten „Abnutzungstheorien“ der Alterungsprozesse im Körper eine Rolle, so dass Wirksubstanzen gegen oxidativen Stress als Mittel gegen das Altern im Gespräch sind. So ist bekannt, dass Zellen von Vögeln weitaus besser freien Radikalen widerstehen können. In diesem Zusammenhang wurde jedoch auch gezeigt, dass Radikale erforderlich sind, um die Abwehrkapazität des Organismus gegen freie Radikale zu steigern; dieser Prozess heißt Mitohormesis und wird durch Antioxidantien verhindert, wie von Michael Ristow und Mitarbeitern gezeigt.[1]
Historische Bedeutung
Als sich zu Beginn des 19. Jahrhunderts die Theorie durchsetzte, dass alle Materie aus Atomen aufgebaut ist (siehe John Dalton), wurde von bedeutenden Chemikern wie Lavoisier und Wöhler der Begriff Radikal verwendet, um mehratomige Moleküle zu bezeichnen, die sich in chemischen Reaktionen wie Einzelatome verhielten.[2] Zum Beispiel verhält sich das Cyanat-Ion, das aus drei Atomen aufgebaut ist, häufig wie ein Chlorid-Ion. Ebenso verhält sich ein Ammonium-Ion, das aus fünf Atomen besteht, oft wie das Ion eines Alkalimetalls. Deshalb wurden unter anderem Cyanat- und Ammonium-Ionen als Radikale bezeichnet. Siehe auch: Radikaltheorie.
Literatur
- Christoph Rüchardt: Radikale. Eine chemische Theorie in historischer Sicht. In: Sitzungsberichte der Heidelberger Akademie der Wissenschaften, Mathematisch-naturwissenschaftliche Klasse, Jahrgang 1992, S. 319–345 (Volltext)
Quellen
- ↑ Artikel bzgl. der negativen Wirkung von Antioxidantien auf die menschliche Gesundheit
- ↑ John Buckingham: Chasing the molecule. Stroud : Sutton, 2004., ISBN 0-7509-3345-3
Weblinks
Wikimedia Foundation.