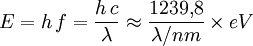- UVVIS
-
Die UV/Vis-Spektroskopie ist eine Spektroskopie, die elektromagnetische Wellen des ultravioletten (UV) und des sichtbaren (engl. visible, VIS) Lichts nutzt. Die Methode ist auch unter UV/VIS-Spektralphotometrie bekannt.
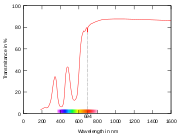 UV-VIS-NIR-Spektrum eines ein zentimeter dicken Rubin-Kristalls
UV-VIS-NIR-Spektrum eines ein zentimeter dicken Rubin-KristallsInhaltsverzeichnis
Prinzip
Moleküle werden mit Elektromagnetischen Wellen im Bereich des sichtbaren und ultravioletten Lichts bestrahlt. Valenzelektronen von beispielsweise p- und d-Orbitalen der äußeren Schalen werden angeregt.
Der Zusammenhang zwischen der Wellenlänge des absorbierten Lichts und der aufzuwendenden Energie, um ein Elektron von einem besetzten (HOMO) auf ein unbesetztes, höheres Orbital (LUMO) anzuheben, ist durch die Einstein-Bohr-Gleichung
gegeben, wobei E die Energie, h das Plancksche Wirkungsquantum, c die Lichtgeschwindigkeit, f die Frequenz und λ die Wellenlänge der elektromagnetischen Welle sind.
Aufbau eines Zweistrahl-UV/Vis-Spektrometers
Die Lichtquelle strahlt Licht im Wellenlängenbereich von etwa 200 nm bis 800 nm aus. Im Monochromator wird zunächst die zur Messung ausgewählte Wellenlänge selektiert, worauf der Lichtstrahl auf den Sektorspiegel fällt. Der Sektorspiegel lässt das Licht abwechselnd durch die Messlösung und durch die Vergleichslösung fallen. Beide Lösungen befinden sich in sogenannten Küvetten. Die zwei Lichtstrahlen werden im Detektor empfangen und die Intensitäten im Verstärker verglichen. Der Verstärker passt dann die Intensität des Lichtstrahls aus der Vergleichslösung durch Einfahren der Kammblende der Intensität des Lichtstrahls aus der Messlösung an. Diese Bewegung wird auf einen Schreiber übertragen oder die Messwerte an eine Datenverarbeitung weitergegeben.
Chemische Beispiele
Nützlich sind die π → π* - Übergänge bei ungesättigten Kohlenwasserstoffen (beispielsweise Alkenen). Sie erfolgen über längerwelliges UV-Licht und sind einfach zu messen. Man erhält Informationen über die absorbierende Wellenlänge des Moleküls, die Struktur und Farbe. Dabei erfolgt die Lichtabsorption im umso längerwelligen Bereich, je größer die Anzahl der aufeinanderfolgenden (konjugierten) Doppelbindungen ist. Liegt die Energie der π → π* - Übergänge im Bereich des sichtbaren Lichts, so erscheint das Molekül farbig. Dabei nimmt es immer die Komplementärfarbe des absorbierten Lichts an.
Bei den betrachteten Elektronenübergängen sind stets die folgenden Auswahlregeln zu beachten (u. a. Laporte-Regel):
1. Spinregel: Der Gesamtspin muss erhalten bleiben
-
- Bsp.: Übergänge zwischen verschiedenen Spinmultiplizitäten sind verboten
2. Verbot von Übergängen gleicher Parität
-
- Bsp:
- verboten ist der Übergang 3s → 4s
- erlaubt ist der Übergang 3s → 3p/4p
- verboten ist der Übergang von gerade → gerade (Orbital)
Achtung: Verboten heißt nicht, dass diese Übergänge nicht vorkommen
-
- Bsp.: wegen der Vibrationskopplung der Kerne beobachtet
3. Überlappungsregel: nur bei ähnlicher Symmetrie und Größe
Siehe auch
Wikimedia Foundation.