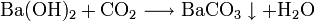- Barytlauge
-
Kristallstruktur Keine Kristallstruktur vorhanden Allgemeines Name Bariumhydroxid Andere Namen - Ätzbaryt
- Barytwasser (wässr. Lösung)
Verhältnisformel Ba(OH)2 CAS-Nummer 17194-00-2 (wasserfrei)
22326-55-2 (Monohydrat)
12230-71-6 (Octahydrat)Kurzbeschreibung weiße Kristalle Eigenschaften Molare Masse 171,34 g·mol−1 Aggregatzustand fest
Dichte Schmelzpunkt Siedepunkt Zersetzung bei >600 °C zu Bariumoxid und Wasser[1]
Löslichkeit Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Ätzend (C) R- und S-Sätze R: 20/22-34 S: 26-36/37/39-45 MAK 0,5 mg·m−3 [1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Bariumhydroxid (Ba(OH)2 ist das Hydroxid des Erdalkalimetalls Barium. Es ist in wässriger Lösung eine starke Base.
Inhaltsverzeichnis
Gewinnung und Derstellung
Ausgehend vom Schwerspat (Bariumsulfat) BaSO4 wird Bariumhydroxid aus Bariumoxid oder Bariumsulfid gewonnen: Bariumoxid reagiert mit Wasser zum Bariumhydroxid:
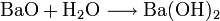 ,
,
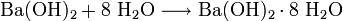 .
.
Bariumsulfid reagiert mit Wasser zu Bariumhydroxid und Schwefelwasserstoff:
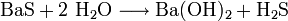 .
.
Eigenschaften
Physikalische Eigenschaften
Bariumhydroxid ist eine feste, aus farblosen Kristallen bestehende Substanz. Es bildet zwei Hydrate, ein Monohydrat und ein Octahydrat. Die Löslichkeit in Wasser ist stark temperaturabhängig, bei 20 °C lösen sich 56 g/l Wasser, bei 80 °C 947 g/l Wasser. Die wässrige Lösung, auch Barytwasser genannt, reagiert stark alkalisch, da Bariumhydroxid fast vollständig in Ionen dissoziiert. Eine gesättigte Lösung hat einen pH-Wert von 14.
Chemische Eigenschaften
Bariumhydroxid bildet in wässriger Lösung mit Kohlenstoffdioxid oder anderen carbonathaltigen Salzen einen schwer löslichen Niederschlag aus Bariumcarbonat:
Es kann so zum qualitativen Nachweis von Carbonationen herangezogen werden.
Verwendung
- Glas- und Keramikherstellung. Teilweise als Ersatz für Bariumcarbonat
- Wasserenthärtung
- Im 18. Jahrhundert in Verbindung mit Ammoniumthiocyanat zur Eisherstellung verwendet, aufgrund der stark endothermen Reaktion. (Reaktion ist exergonisch.)
- Zum Nachweis von Kohlenstoffdioxid und Carbonaten
- Das Octahydrat kann als Wärmespeicher verwendet werden[2]
Einzelnachweise
Wikimedia Foundation.