- Batterien
-
Der Begriff „Batterie“ bezeichnet ursprünglich eine Zusammenschaltung (zumeist die Reihenschaltung) mehrerer als Energiequelle genutzter galvanischer Zellen, jedoch ist es in der Alltagssprache üblich geworden, auch eine einzelne Zelle so zu bezeichnen.
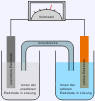
Eine solche Zelle ist ein elektrochemischer Energiespeicher und ein Energiewandler. Bei der Entladung wird gespeicherte chemische Energie durch die elektrochemische Redoxreaktion in elektrische Energie umgewandelt. Diese kann von einem vom Stromnetz unabhängigen elektrischen Verbraucher genutzt werden. Alternativ kann sie auch in einem vom Stromnetz abhängigen Verbraucher eingesetzt werden, um kurzzeitige Ausfälle im Stromversorgungsnetz zu überbrücken und so eine unterbrechungsfreie Stromversorgung sicherzustellen.
In nicht wiederaufladbaren Primärbatterien sind die Reaktionen bei der Entladung nicht oder nur teilweise umkehrbar. Dagegen sind sie in wiederaufladbaren Sekundärbatterien (Akkumulatoren) weitgehend umkehrbar, so dass eine mehrfache Umwandlung von chemischer in elektrische Energie und zurück möglich ist.
Aufgrund der vielen Einsatzbereiche mit sehr unterschiedlichen Anforderungen bezüglich Spannung, Leistung und Kapazität gibt es heute Batterien in nahezu unüberschaubaren Ausführungen.
Inhaltsverzeichnis
Grundlagen
 9-V-Blockbatterie, aufgeschnitten
9-V-Blockbatterie, aufgeschnittenDie Elektrodenmaterialien legen die Nennspannung der Zelle fest. Höhere Spannungen erhält man durch Hintereinanderschalten (Reihenschaltung) mehrerer Zellen.
Als Kapazität einer Batterie (nicht zu verwechseln mit der elektrischen Kapazität) wird die in der Batterie gespeicherte elektrische Ladung bezeichnet. Man unterscheidet die theoretische Kapazität (hängt von der Menge des aktiven Materials in der Batterie ab) von der unter bestimmten Bedingungen entnehmbaren Ladung („praktische“ Kapazität). Die Kapazität wird meist in Amperestunden (Abkürzung: Ah) und selten in Coulomb (Einheitenzeichen: C) angegeben. Die Kapazität hängt nicht von der Anzahl der hintereinander in Reihe geschalteten Zellen ab, erhöht sich jedoch bei Parallelschaltung.
Die entnehmbare Kapazität einer Batterie hängt von den Entladebedingungen (beispielsweise Belastung, Entladeschlussspannung, Temperatur) sowie der Vorgeschichte der Batterie (beispielsweise Dauer und Bedingungen der Lagerung vor der Entladung) ab. Deswegen werden praktische Batteriekapazitäten durch genormte Entladeverfahren unter vorgegebenen Bedingungen bestimmt. Zu den üblichen Entladeverfahren zählen die Entladung mit konstantem Strom, die Entladung über einen konstanten Widerstand und die Entladung mit konstanter Leistung. Je nach Entladeverfahren weist die Batterie eine andere Kapazität auf. In einer sinnvollen Angabe der Nennkapazität müssen daher Entladeverfahren und Entladebedingungen mit aufgeführt werden. Batteriekapazitäten können den Datenblättern der Batteriehersteller entnommen werden.
Generell nimmt die entnehmbare Kapazität einer Batterie mit zunehmendem Entladestrom ab. Gründe dafür sind die zunehmenden Verluste am Innenwiderstand der Batterie und die begrenzte Geschwindigkeit der elektrochemischen Prozesse und Transportvorgänge in der Batterie. Die Verringerung der entnehmbaren Kapazität mit zunehmendem Entladestrom ist stark vom elektrochemischen System und dem Aufbau der Batterie abhängig.
Die Batteriekapazität oder der Maximalstrom bei gegebener Spannung lassen sich durch größer gebaute Zellen oder durch Parallelschaltung von Zellen oder Batterien erhöhen.
Die Leistung einer Batterie ist die Menge an elektrischer Energie, die pro Zeiteinheit entnommen werden kann. Sie wird in der Regel in Watt (Einheitenzeichen W) angegeben und ist das Produkt aus Entladestrom und Entladespannung.
Die in einer Batterie gespeicherte Energie wird meist nicht angegeben, die Energie pro Masse oder pro Volumen ist jedoch eine wichtige Kenngröße von Batteriesystemen.
Alle Batterien unterliegen bei Lagerung der Selbstentladung. Die Geschwindigkeit der Selbstentladung hängt unter anderem vom Batterietyp und der Temperatur ab. Je niedriger die Lagertemperatur, desto geringer ist die Selbstentladung.
Entsorgung
In Deutschland regelt die Batterieverordnung die Rücknahme und Entsorgung von Batterien. Sie legt unter anderem fest, dass in Deutschland keine Batterien oder Zellen mit einem Quecksilbergehalt von mehr als 0,0005 Gewichtsprozent in den Verkehr gebracht werden dürfen. Bei Knopfzellen darf der Quecksilbergehalt nicht über 2,0 Gewichtsprozent liegen. Alkali-Mangan-Batterien enthalten seit Beginn der 1990er Jahre kein Quecksilber mehr. Davor wurde es zum Amalgamieren des Elektrodenmaterials Zink verwendet.
Kleine Batterien können in Deutschland in die Einzelhandelsgeschäfte zurückgebracht werden, wenn diese auch Batterien verkaufen. Zu diesem Zweck müssen dort Sammelbehälter aufgestellt sein.
Für Autobatterien existiert in Deutschland ein Pfandsystem.
Batterien und Akkumulatoren gehören nicht in andere Müllsammelbehälter oder in die Umwelt, da sie potenziell umweltschädliche und zudem wiedergewinnbare wertvolle Rohstoffe enthalten.
Adapter und Kontaktierung
Nicht jeder Batterietyp ist in jedem Land erhältlich. Deshalb gibt es zum Beispiel Flachbatterie-Adapter, die drei AA-Zellen zu je 1,5 V aufnehmen. Diese lassen sich in allen Geräten verwenden, in die auch eine Flachbatterie hineinpasst. Nützlich sind diese Adapter auch, weil es bis dato keine wiederaufladbaren Flachbatterien gibt.
Manche Batteriehersteller bauen gleichartige Primärzellen in unterschiedliche Gehäusegrößen ein.
Die Kontaktierung kleiner Batterien erfolgt meist mit Federkontakten, zuverlässigere Ausführungen für Lithiumbatterien sind vergoldet, um die Zellenspannung exakt bestimmen zu können. Fest eingebaute Akkumulatoren sind mit Steckkontakten, Polbolzen oder Lötfahnen versehen.
Batteriepacks aus mehreren Zellen sind untereinander mit Blechbändern verschweißt.
Auslaufende Batterien (besonders Zink-Kohle-Zellen, aber auch austretende Schwefelsäure bei Bleiakkumulatoren) führen zu Korrosion und erhöhten Kontakt-Übergangswiderständen.
Geschichte
Das erste funktionierende galvanische Element und damit die erste Batterie wurde in Form der Voltaschen Säule im Jahr 1800 von Alessandro Volta vorgestellt. 1901 entwickelte Paul Schmidt in Berlin die Trockenbatterie und begründete die DAIMON-Werke.
Regelmäßig wieder auftretende Mutmaßungen über bereits in der Antike genutzte Batterien gründen sich hauptsächlich auf ein einzelnes Tongefäß, das 1936 von dem österreichischen Archäologen Wilhelm König südöstlich von Bagdad entdeckt wurde und in dem er ein galvanisches Element zu erkennen glaubte. Aus verschiedenen Gründen ist die Funktion dieses als „Bagdad-Batterie“ bekannt gewordenen Gefäßes zweifelhaft.
Typvariationen
Handelsübliche Batterien und Zellen unterscheiden sich sowohl in dem zugrunde liegenden chemischen Redoxsystem als auch in den elektrischen Werten oder der geometrischen bzw. konstruktiven Bauform. Von den nachfolgend aufgeführten Bezeichnungen können mehrere zusammen einen Batterietyp beschreiben, z. B. „Alkali-Mangan-Batterie – LR 6/AM-3 – AA – Mignon“. Oft wird aber nur ein bestimmtes Merkmal gefordert, z. B. die Größe „AA“ für eine speziell darauf abgestimmte Taschenlampe. Von einer Trockenbatterie spricht man, wenn der Elektrolyt, etwa durch Eindickung, nicht flüssig vorliegt. Dadurch wird die Batterie in beliebiger räumlicher Orientierung einsetzbar, also insbesondere für mobile Anwendungen.
Im experimentellen Bereich und zur Veranschaulichung des Funktionsprinzips werden recht exotische Batterien, wie zum Beispiel Zitronenbatterien, eingesetzt.
Einsatzbereiche
Je nach dem Einsatzgebiet gibt es folgende Begriffe und Zuordnungen:
- Gerätebatterien dienen zur Stromversorgung kleiner, meist tragbarer Geräte, beispielsweise in Taschenlampen oder Mobiltelefonen. Besonders kleine Ausführungen für Hörgeräte oder Quarzuhren werden als Knopfzellen bezeichnet.
- Starterbatterien für Kraftfahrzeuge, Traktionsbatterien für Elektrofahrzeuge und stationäre Batterien bei ortsfesten Anwendungen wie beispielsweise Unterbrechungsfreie Stromversorgung sind immer Akkumulatoren.
Primärzellen
Primärzellen sind galvanische Zellen, die nach der Entladung nicht wieder neu aufgeladen werden können. Sie werden heute meist als Trockenbatterie ausgeführt. Die verschiedenen Typen werden nach den eingesetzten Materialien bezeichnet:
- Alkali-Mangan-Batterie; 1,5 Volt Nennspannung pro Zelle
- Zink-Kohle-Batterie; 1,5 Volt pro Zelle
- Nickel-Oxyhydroxid-Batterie; 1,5 Volt pro Zelle
- Lithium-Batterien; je nach Kathodenmaterial 2,9 bis 3,6 V
- Lithium-Eisensulfid-Batterie; 1,5 Volt pro Zelle
- Zink-Luft-Batterie; 1,5 Volt pro Zelle
- Zinkchlorid-Batterie; 1,5 Volt pro Zelle
- Quecksilberoxid-Zink-Batterie; 1,35 Volt pro Zelle
- Silberoxid-Zink-Batterie; 1,55 Volt pro Zelle
- Natrium-Nickelchlorid-Batterie (Zebra-Batterie); 2,58 Volt pro Zelle
Baugrößen
Als Gerätebatterien werden häufig Batterien bezeichnet, die sehr verbreitet für die Energieversorgung von Elektrokleingeräten wie Uhren, Radios, Spielzeug, Taschenlampen u.ä. und auch in fest installierten Geräten wie Rauchmeldern verwendet werden.
Gerätebatterien müssen kompakt, lageunabhängig einsetzbar, leicht und trotzdem mechanisch robust sein. Sie dürfen bei normaler Lagerung und Verwendung im Gerät weder auslaufen noch ausgasen. Sie sind in einer Vielzahl von Ausführungen auf der Basis von Zink-Kohle- oder Alkali-Mangan-Batterie im Handel erhältlich. Ihre Bezeichnung folgt den von der IEC festgelegten Leistungsklassen[1] und den von der ANSI genormten Baugrößen.
Zink-Kohle Batterien werden immer seltener angeboten und teilweise schon nicht mehr hergestellt. Die am häufigsten verwendeten Batteriegrößen (sog. „Big-5“):
IEC
Alkali-Mangan
(Zink-Kohle)ANSI Bezeichnung Größe Nennspannung Kapazität (mAh)
Zink-KohleKapazität (mAh)
Alkali-ManganLR03 / AM-4
(R03 / UM-4)AAA Micro Ø 10,3 x H 45 mm 1,5 V 370…540 900…1.450 LR06 / AM-3
(R6 / UM-3)AA Mignon Ø 14,3 x H 51 mm 1,5 V 700…1.100 2.200…3.500 LR14 / AM-2
(R14 / UM-2)C Baby Ø 27 x H 50 mm 1,5 V 1.800…3.800 ≈ 8.000 LR20 / AM-1
(R20 / UM-1)D Mono Ø 35 x H 62 mm 1,5 V 4.000…8.000 ≈ 20.000 6LR61 / AM-6
(6F22)1604D
PP3E-Block
9V-BlockL 48,5 x B 26,2 x H 17 mm 9,0 V (beinhaltet 6 Zellen à 1,5 V)
6LR61 = 6x Rundzelle LR61
6F22 = 6x Flachzelle 22190…330 500…600 Hier nicht aufgeführt ist die ebenfalls genormte Größe SUB-C.
Neben diesen „Standardtypen“ gibt es noch eine große Formenvielfalt bei produktspezifischen Batterien, beispielsweise für Fotoapparate und bei Knopfzellen.
Batterien, die seltener eingesetzt werden und teilweise auch nur in Fachgeschäften erhältlich sind:
IEC
Alkali-Mangan
(Zink-Kohle)ANSI Bezeichnung Größe Nennspannung Kapazität (mAh)
Zink-KohleKapazität (mAh)
Alkali-ManganLR61 AAAA Mini Ø 8,3 x H 42,5 mm 1,5 V 300 500…600 LR1 / AM-5
(R1 / UM-5)N Lady Ø 12 x H 30 mm 1,5 V ≈ 400 ≈ 800 2LR10
(2R10)Duplex Stabbatterie Ø 21,8 x H 74,6 mm 3,0 V
(beinhaltet 2 Zellen à 1,5 V)1.000…1.500 3LR12
(3R12 / 1203)Flachbatterie L 67 x B 62 x H 22 mm 4,5 V
(beinhaltet 3 Zellen à 1,5 V)≈ 1.800 ≈ 5.900 4LR61 J Flat Pack L 49 x B 36 x H 8,5 mm 6,0 V
(beinhaltet 4 Zellen à 1,5 V)500…600 (6F90) PP7 L 62,2 x B 46 x H 46 mm 9,0 V
(beinhaltet 6 Zellen à 1,5 V)ca. 2.000 (6F100) PP9 Blockbatterie L 80 x B 64,5 x H 51 mm 9,0 V
(beinhaltet 6 Zellen à 1,5 V)4.300 (4R25) 908D Laternenbatterie L 112 x B 66,7 x H 66,7 mm 6,0 V
(beinhaltet 4 Zellen à 1,5 V)8.500-9.500 8LR23 1181A A23 Batterie Ø 10,3 x H 28,9 mm 12,0 V
(beinhaltet 8 Zellen à 1,5 V)≈ 33 Siehe auch
- Separator (Batterie)
- Batterierecycling
- Atombatterie
- Deflagrator
- Starterbatterie
- Bleiakkumulator
- Knopfzelle
Literatur
- Lucien F. Trueb, Paul Rüetschi: Batterien und Akkumulatoren – Mobile Energiequellen für heute und morgen. Springer, Berlin 1998, ISBN 3-540-62997-1
- David Linden, Thomas B. Reddy (Hrsg.): Handbook of Batteries. 3. Auflage. McGraw-Hill, New York 2002, ISBN 0-07-135978-8 (englisch)
- Clive D.S. Tuck (Hrsg.): Modern Battery Technology. Ellis Horwood, New York 1991, ISBN 0-13-590266-5 (englisch)
- Philipp Brückmann: Autonome Stromversorgung - Auslegung und Praxis von Stromversorgungsanlagen mit Batteriespeicher. Ökobuch, Staufen 2007, ISBN 978-3-936896-28-2
Einzelnachweise
Weblinks
- Geschichte der elektrischen Energiespeicherung
- Battery Chemistry FAQ (Englisch)
- Die „ideale“ Batterie / Leistungsvergleich
- Stiftung Gemeinsames Rücknahmesystem Batterien
- Technische Daten und Vergleichslisten für Knopfzellen und Batterien (PDF)
- Vergleichtabelle für Bezeichnungen diverser Hersteller
Primärzellen: Alkali-Mangan-Batterie | Daniell-Element | Leclanché-Element | Lithium-Batterie | Lithium-Eisensulfid-Batterie | Nickel-Oxyhydroxid-Batterie | Quecksilberoxid-Zink-Batterie | Silberoxid-Zink-Batterie | Zink-Braunstein-Zelle | Zinkchlorid-Batterie | Zink-Luft-Batterie
Sekundärzellen: Bleiakkumulator | Natrium-Schwefel-Akkumulator | Nickel-Cadmium-Akkumulator | Nickel-Eisen-Akkumulator | Nickel-Metallhydrid-Akkumulator | Nickel-Wasserstoff-Akkumulator | Lithium-Eisen-Phosphat-Akkumulator | Lithium-Ionen-Akkumulator | Lithium-Mangan-Akkumulator | Lithium-Polymer-Akkumulator | Lithium-Titanat-Akkumulator | Vanadium-Redox-Akkumulator
Ausführungen: Akkumulator | Batterie | Brennstoffzelle | Konzentrationselement | Redox-Flow-Zelle | Bestandteile: Halbzelle (Donator- und Akzeptorhalbzelle)
Wikimedia Foundation.