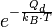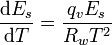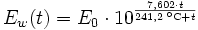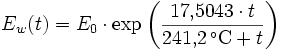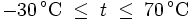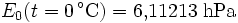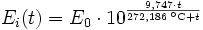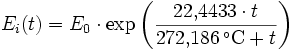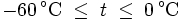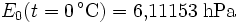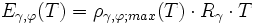- Wasserdampfsättigungsdruck
-
Der Sättigungsdampfdruck ist der Druck der dampfförmigen Phase eines Stoffes, wenn die flüssigförmigen und dampfförmigen Phasen sich im Gleichgewicht befinden. Der Sättigungsdampfdruck eines Reinstoffes ist lediglich von seiner Temperatur abhängig.
Achtung: Üblicherweise wird der Sättigungsdampfdruck in der Chemie mit „Dampfdruck“ abgekürzt. Hier ist die Gefahr groß, dass man den Begriff des Sättigungsdampfdruckes mit dem des Partialdrucks verwechselt. Deshalb wird der Begriff "Dampfdruck" hier nicht verwendet.
Geschichte
Im 19. Jahrhundert beschäftigte sich John Dalton mit der Frage, wie viel Wasserdampfvolumen notwendig war, um die Luft zur Sättigung zu bringen. Seine erste Feststellung war, dass dieses Volumen sehr stark von der Temperatur abhängt.
Definition
Der Sättigungsdampfdruck eines Reinstoffes bei gegebener Temperatur ist der Druck, der im Gleichgewicht in einer ansonsten leeren Kammer über der flüssigen Phase entsteht. In diesem Zustand ist die Verdampfung bzw. Sublimation der Flüssigkeit bzw. des Feststoffes mengenmäßig gleich der Kondensation bzw. Resublimation des Gases. Keine der Phasen wächst unter dem Strich auf Kosten der anderen, wodurch beide nebeneinander stabil existieren können. Bei einer Temperatur- oder Volumenänderung verdampft oder kondensiert so viel des Stoffes, bis im Gleichgewicht der Druck wieder den Sättigungsdampfdruck erreicht.
Anstelle der flüssigen Phase entsteht bei Temperaturen unterhalb des Tripelpunkts der Feststoff, zum Beispiel Iod bei Raumtemperatur.
Befinden sich im Probenvolumen mehrere ineinander unlösliche flüssige Phasen, so entsteht darüber ein Druck, dessen Partialdrücke jeweils den Sättigungsdampfdrücken der einzelnen Stoffe entsprechen und dies unabhängig vom Gesamtdruck. Ist der Sättigungsdampfdruck einer Komponente, und damit der Dampfdruck innerhalb dieser flüssigen Phase, größer als der Gesamtdruck, so beginnt diese Komponente zu sieden.
Lösungen, die als eine Phase vorliegen, kommen von der Zusammensetzung abhängiger eigene Sättigungsdampfdrücken mit bestimmten Partialdrücken zu, die verschieden zu den Sättigungsdampfdrücken der einzelnen Komponenten sind.
Mikroskopisch betrachtet wird der Dampfdruck durch die Oberflächenspannung eines Stoffes bestimmt. Der Dampfdruck von Wasser als feinster Nebel ist höher als von kompakten Tropfen. Daher kann Wassergas stark unterkühlt werden.
Formelzeichen und Einheit
Für den Sättigungsdampfdruck wird meist das Formelzeichen E verwandt, es sind jedoch auch weitere Formen wie es und ps, max, für flüssiges Wasser speziell ew und pw, max sowie für Eis ei und pi, max gebräuchlich. Die jeweiligen Indizes finden sich auch beim groß geschriebenen E. Je nach Anwendungsgebiet werden unterschiedliche Druckeinheiten genutzt, wobei in den Naturwissenschaften Hektopascal (hPa) und Megapascal (MPa), in den Ingenieurswissenschaften hingegen Bar (bar) am gebräuchlichsten sind.
Der Sättigungsdampfdruck im Phasendiagramm
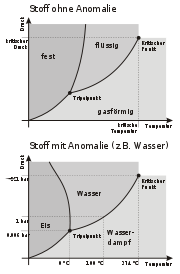 Phasendiagramm eines „gewöhnlichen“ Stoffes und des Wassers (Dichteanomalie)
Phasendiagramm eines „gewöhnlichen“ Stoffes und des Wassers (Dichteanomalie)Im Phasendiagramm ist der Sättigungsdampfdruck nichts anderes als der Wert des Druckes entlang der hier als schwarz gekennzeichneten Phasengrenzlinie zwischen der Gasphase und der korrespondierenden festen bzw. flüssigen Phase. Diese Phasengrenzlinie wird daher auch als Dampfdruckkurve oder Sättigungsdampfdruckkurve bezeichnet. Für das Phasengleichgewicht von Gas-Festkörper heißt der Sättigungsdampfdruck auch Sublimationsdruck und für das Phasengleichgewicht von Gas-Flüssigkeit auch Siededruck. Zu beachten ist hierbei, dass bei Temperaturen über dem kritischen Punkt keine flüssige Phase und somit auch kein Sättigungsdampfdruck mehr existieren. Des Weiteren spielt die Phasengrenzlinie zwischen Feststoff und Flüssigkeit, die so genannte Schmelzkurve, keine Rolle für den Sättigungsdampfdruck.
Anwendungen und Bedeutung
Der Sättigungsdampfdruck ist ein Maß für den Anteil derjenigen Moleküle oder Atome, die genügend Energie besitzen, die Nah- und Fernordnung, die (Kohäsionskräfte und die Oberflächenspannung) zu überwinden und in die gasförmige Phase zu wechseln. Die Wahrscheinlichkeit dafür gibt die Boltzmann-Statistik an. Daher ist die Dampfdruckkurve proportional zum Boltzmann-Faktor:
wobei Qd die Verdampfungsenergie eines Moleküls oder Atoms ist.
Daraus ergib sich, dass im Gleichgewichtszustand die Teilchenzahl eines spezifischen Gasvolumens bei höheren Temperaturen größer als bei niedrigeren Temperaturen ist, was auch gleichbedeutend damit ist, dass mit der Temperatur die Teilchendichte ansteigt.
Wichtige Beispiele sind Wasserdampf und Luftfeuchtigkeit. Viele Feuchtemaße werden über Dampfdruck und Sättigungsdampfdruck definiert oder berechnet, besonders im Zusammenhang der relativen Luftfeuchtigkeit, des Sättigungsdefizits und des Taupunkts.
Die mit dem Sättigungsdampfdruck beschriebenen thermodynamischen Eigenschaften sind von größter Bedeutung und finden auch in nahezu allen naturwissenschaftlichen und technischen Disziplinen eine mannigfaltige Verwendung, wobei Wasser hier zwar den wichtigsten Stoff darstellt, diese Anwendungen jedoch auch keineswegs auf Wasser beschränkt bleiben. Besonders bedeutungsvoll sind hierbei die Effekte (siehe unten) einer realen Umgebung auf den theoretisch hergeleiteten Sättigungsdampfdruck, da sich hieraus viele für die Meteorologie aber auch für technische Anwendungen wichtige Erkenntnisse und Anwendungen ableiten. Ein Beispiel für eine Anwendung des Sättigungsdampfdruckes in der Technik ist die Gefriertrocknung, ein weiteres die Druckkochung. (Siehe Schnellkochtopf). In der Bauphysik wird nach dem Glaser-Verfahren (einem Vergleich von Sattdampfdrücken entsprechend dem Temperaturprofil und den jeweils theoretisch herrschenden Partialdampfdrücken an den Schichtgrenzen des Bauteils) stationär abgeschätzt, ob ein vorgesehenes Bauteil durch ausfallendes Tauwasser gefährdet ist.
Berechnung und Einflussfaktoren
Für die Berechnung des Sättigungsdampfdruckes kann man die Clapeyron-Gleichung bzw. speziell für den Phasenübergang flüssig nach gasförmig auch die Clausius-Clapeyron-Gleichung nutzen. In Anwendung auf den Sättigungsdampfdruck lautet diese:
Die einzelnen Formelzeichen stehen für folgende Größen:
- Es - Sättigungsdampfdruck in hPa
- qv - spezifische Verdampfungswärme (Verdampfungswärme pro Masse)
- Rw - spezifische Gaskonstante
- T - Temperatur
Diese Gleichung ist jedoch mit praktischen Problemen behaftet, da man sie nur schlecht integrieren kann (Temperaturabhängigkeit der Verdampfungswärme). Wenn man annimmt, dass qv (die Verdampfungswärme) konstant wäre dann ergibt sich für den Sättigungsdampfdruck:
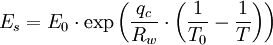
Im Falle des für viele Anwendungen sehr wichtigen Sättigungsdampfdruckes des Wassers hat man daher verschiedene Näherungsgleichungen entwickelt, deren einfachster Typ die Magnus-Formeln sind. Die derzeit exakteste Gleichung zur Berechnung des Dampfdruckes über Wasser ist die Goff-Gratch-Gleichung - ein Polynom sechsten Grades in Logarithmen der Temperatur - die auch von der Weltorganisation für Meteorologie empfohlen wird.
Berechnung des Sättigungsdampfdrucks von Wasser über die Magnus-Formel
Der Sättigungsdampfdruck für Wasserdampf kann mit Hilfe der Magnus-Formel (hier nach Sonntag 1982, siehe Literatur) berechnet werden.
Über ebenen Wasseroberflächen
oder
wobei gilt:
Über ebenen Eisoberflächen
oder
wobei gilt:
Hinweise
In den Magnus-Formeln ist zu beachten, dass für t die Temperatur in Grad Celsius und nicht in Kelvin einzutragen ist. Der sich ergebende Sättigungsdampfdruck hat die Einheit des Vorfaktors E0(t), also bei dem hier angegebenen Werten hPa. Jenseits von auf der Erde natürlich auftretenden Temperaturwerten kann die Abweichung der empirisch ermittelten Magnus-Formel zum realen Wert stark zunehmen, weshalb man sich auf die angegebenen Temperaturbereiche beschränken sollte.
Die Magnus-Formeln gelten nur für ebene Oberflächen und auch hier nur für reines Wasser. Ihr Fehler ist jedoch vergleichsweise recht groß, so dass diese beiden Effekte bei einer geringen Ausprägung meist vernachlässigbar sind. Die Standardabweichung der Ergebnisse beträgt beidseitig bis zu einem halben Prozent. Bei gekrümmten Oberflächen, beispielsweise bei kugelförmigen Tröpfchen, ist der Sättigungsdampfdruck höher (Krümmungseffekt siehe unten), hingegen bei salzhaltigen Lösungen geringer (Lösungseffekt siehe unten). Diese beiden modifizierenden Einflüsse spielen eine wesentliche Rolle bei der Bildung von Niederschlagsteilchen.
Im Laborexperiment kann Kondensation über einer ebenen Fläche mit destilliertem Wasser und einer sehr reinen Luft erst nach Übersättigungen von mehreren hundert Prozent erreicht werden. In der realen Atmosphäre spielen hingegen Aerosole eine wesentliche Rolle als Kondensationskeime. Dies hat zur Folge, dass man in der Realität selten Übersättigungen von mehr als einem Prozent beobachtet.
Zum Vergleich der Magnus-Formel mit einer anderen Darstellungsform ist der Artikel Wasserdampf zu empfehlen. Die Magnus-Formel wurde erstmals 1844 von Heinrich Gustav Magnus aufgestellt und seitdem lediglich durch genauere Werte ergänzt, wobei die hier genutzten Werte aus D. Sonntag (1982) stammen. Eine genauere Berechnung, sowie viele Beispielwerte, finden sich im nächsten Abschnitt.
Effekte
Im Gegensatz zum durch die obigen Gleichungen beschriebenen Idealfall eines Reinstoffes und einer ebenen Oberfläche zeigen sich in der Realität weitere Einflussfaktoren, welche den letztendlichen Sättigungsdampfdruck mitbestimmen.
Krümmungs- und Lösungseffekt
Bei Bildung von Flüssigkeitspartikel an Kondensationskernen tritt der Krümmungseffekt auf. Es zeigt sich dabei, dass über den gekrümmten Oberflächen der entstehenden Flüssigkeitstropfen ein höherer Sättigungsdampfdruck auftritt, als im Vergleich zu einer planaren Wasseroberfläche. Liegt die Flüssigkeit bei einer Änderung des Aggregatzustands nicht als Reinstoff vor, so muss man auch den Lösungseffekt beachten. Die in der Flüssigkeit gelösten Teilchen erschweren es hierbei den Flüssigkeitsverbund zu verlassen, weshalb der Sättigungsdampfdruck niedriger ist, als es bei einer reinen Flüssigkeit der Fall wäre.
Unter atmosphärischen Bedingungen treten beide Effekte meist gemeinsam auf, und eine allein stehende Betrachtung ist wenig zielführend.
Ladungseffekt
Auch die elektrische Ladung der Oberfläche hat eine Auswirkung auf den Sättigungsdampfdruck, welche jedoch im Vergleich zu den anderen Effekten minimal ist und daher keine praktische Rolle spielt.
Korrekturfaktoren für feuchte Luft
Die Korrekturfaktoren (engl.: enhancement factor) sind nötig, da der Wasserdampf nicht in reiner Form vorliegt, sondern innerhalb der feuchten Luft. Sie gelten lediglich bei einem Luftdruck von 1013,25 hPa (Normaldruck). Bei höheren Drücken sind sie größer und dementsprechend bei niedrigeren Drücken kleiner.
- über Wasser im Temperaturintervall von -50 °C bis 90 °C:
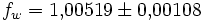
- über Eis im Temperaturintervall von -90 °C bis 0 °C:
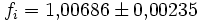
Da die Korrekturfaktoren temperaturabhängig sind und in den obigen Werten recht große Temperaturintervalle umfassen, stellen sie nur recht grobe Näherungen an die tatsächliche Abweichung dar. Die negativen Temperaturen über Wasser beziehen sich auf unterkühltes Wasser. Um die resultierenden Werte für den Sättigungsdampfdruck zu erhalten, gilt:
 - Tabellenwert
- Tabellenwert - Tabellenwert
- Tabellenwert
Zusammenhang mit der Sättigungsmenge
Nach der allgemeinen Gasgleichung ist der Sättigungsdampfdruck (näherungsweise) auch das Produkt der Sättigungsmenge mit der individuellen Gaskonstante und der Temperatur (in Kelvin). Als Formel etwa so dargestellt:
– vgl. Dampfdruck bzw. Sättigung.
- γ steht hier noch für das jeweilige Gas (z. B. Wasserdampf) – mit Gaskonstante Rγ,
- φ für den alternativen Aggregatzustand („Phase“, fest bzw. flüssig); bei γ = Wasserdampf ist Eγ,φ der Wasserdampfdruck und ργ,φ die Sättigungsmenge „über Eis“ bzw. „über Wasser“.
Neben der Bezeichnung Sättigungsmenge findet man auch Sättigungskonzentration und Sättigungs-(dampf-)dichte (Titel von Sonntag 1982), die SI-Einheit ist zumeist g/m3. Bei Wasserdampf spricht man auch von der maximalen Luftfeuchte.
Literatur
- Dietrich Sonntag und Dirk Heinze: Sättigungsdampfdruck- und Sättigungsdampfdichtetafeln für Wasser und Eis. (1. Aufl.), VEB Deutscher Verlag für Grundstoffindustrie, 1982
- L.A. Guildner, D.P. Johnson und F.E. Jones: Vapor pressure of Water at Its Triple Point. J. Res. NBS - A, Vol. 80A, No. 3, p. 505-521, 1976
Der Dampfdruck von IodSiehe auch
- Raoultsches Gesetz - Dampfdruckveränderungen in Lösungen
- Siedepunkt
- Tripelpunkt
Weblinks
- Online-Rechner für die wichtigsten meteorologischen Größen
- Gleichungen zum Sättigungsdampfdruck, zusammengestellt von Holger Vömel (engl.)
- Goff-Gratch Gleichung in der englischsprachigen Wikipedia (engl.)
- Online Rechner mit der Goff-Gratch Gleichung und anderen. (engl.)
Wikimedia Foundation.