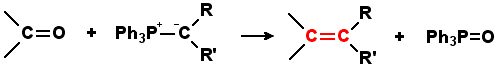- Wittig Reaktion
-
Die Wittig-Reaktion ist eine wichtige Reaktion der organischen Chemie. Als Namensreaktion ist sie nach ihrem Entdecker Georg Wittig benannt. Bei ihr werden Phosphorylide mit Carbonylverbindungen unter Bildung eines Alkens umgesetzt:
Die Wittig-Reaktion ist eine breit anwendbare Methode zur Synthese von Olefinen und toleriert dabei sehr viele funktionelle Gruppen. Als störend für die Wittig-Reaktion erweisen sich normalerweise nur recht saure funktionelle Gruppen wie Carbonsäuren oder 1,3-Dicarbonylverbindungen. Es sind sowohl inter- als auch intramolekulare Varianten dieser Reaktion bekannt. Die Reaktion ist regioselektiv das heisst die neu gebildete Kohlenstoff-Kohlenstoff-Doppelbindung findet sich an der Stelle der früheren Kohlenstoff-Sauerstoff-Doppelbindungen wieder. Als Carbonyl-Komponete kommen Aldehyde und Ketone in Frage. Wobei Aldehyde reaktiver sind und sterisch weniger gehinderte Ketone gegenüber sterisch gehinderten Ketonen selektiv olefiniert werden können. Carbonsäureester sind in einer Wittig-Reaktion nahezu inert.Ein Nachteil ist die prinzipiell wenig ausgeprägte E-/Z-Selektivität, die aber durch geeignete Reaktionsbedingungen gesteuert werden kann. Durch seine hohe Toleranz an funktionellen Gruppen kann die Wittig-Reaktion auch im Wittig-Reagenz eine Vielzahl an funktionellen Gruppen selber mitbringen.
Heute besitzt die Wittig-Reaktion sowohl im organischen Labor als auch in der industriellen Anwendung eine große Bedeutung, wo sie z. B. bei Synthesen olefinischer Naturstoffe wie Vitamin A und D, Carotinoiden (β-Carotin s. u.), Squalen, ungesättigten Pheromonen, Insektenhormonen, Riechstoffen und Prostaglandinen eingesetzt wird.
Geschichte
Wittig hat bei seinen Experimenten zur Quartärnisierung der Hauptgruppenelemente ein Zwitterion erhalten welches bemerkenswerte Eigenschaften aufwies. In Gegenwart von Carbonyl-Verbindungen reagierten sie glatt mit dem Carbonyl-Kohlenstoff unter Ausbildung einer Kohlenstoff-Doppelbindung und Triphenylphosphinoxiden.[1] [2]
Wittig publizierte diese 1947 an der Universität Tübingen entdeckte neuartige Reaktion unter dem Titel Über Triphenyl-phosphin-methylene als olefinbildende Reagenzien und nannte diese Reaktion fortan Carbonyl-Olefinierung. Der Name Wittig-Reaktion wurde später jedoch gebräuchlich. Heute wird in der Regel das Triphenylalkylphosphoniumsalz als Wittig-Salz für diese Reaktion eingesetzt und man erhält als Nebenprodukt Triphenylphosphinoxid.
Die Wittig-Reaktion erwies sich schnell als sehr vielseitig und universell einsetzbar, dass diese Entdeckung im Jahr 1979 mit dem Nobelpreis für Chemie gewürdigt wurde.
Erste industrielle Anwendungen
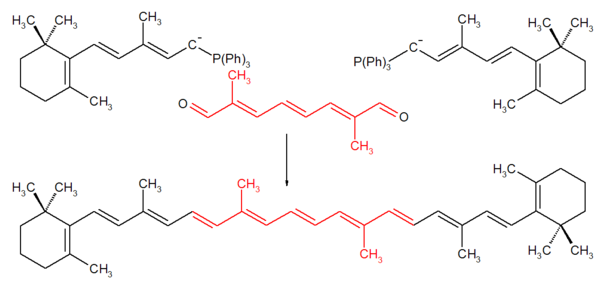
Mit Begeisterung nahm die BASF die neue Methode zur Kenntnis. Sie erlaubte es einen bereits vorhandenen Synhesebaustein (Derivat von (2E,4E)-3-methyl-5-(2,6,6-trimethylcyclohex-1-en-1-yl)pentan) mit dem leicht zugänglichen (2E,4E,6E)-2,7-dimethylocta-2,4,6-trienedial zu β-Carotin zu verknüpfen. Bereits drei Jahre nach der Publikation von Wittig wurde ein Patent eingereicht. (BASF)[3] [4];
Herstellung der Ylide
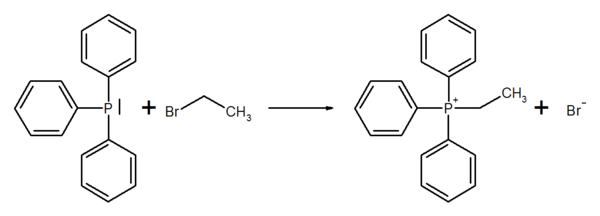
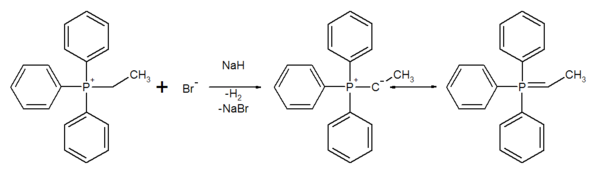
Trisubstituierte Phosphoralkyle/aryle lassen sich in einer SN2-Reaktion quarternisieren. Triphenylphosphin reagiert beispielsweise mit Ethylbromid zu Ethyltriphenylphosponiumbromid:
Triphenylphoshin und Ethylbromid werden im Autoklaven in Benzol 20 h auf 130 °C erhitzt. Bei Abkühlen fällt das Phosphomiumsalz kristallin aus (Ausbeute 90 %).[5]
Phosphine sind gute Nucleophile, aber schlechte Basen. Auf diesem Grunde wird die der SN2-Reaktion konkurrierende E2-Elimination fast vollständig unterdrückt. So lassen sich die meisten primären und sekundären Alkylhalogenide in guten Ausbeuten in ihre Phosphoniumsalze überführen.
Im Gegensatz zu den meist isolierten Phosphoniumhalogeniden, werden die daraus durch eine Deprotonierung am α-C-Atom hergestellten Ylide meist direkt weiterumgesetzt.
Unter Inertgas in DMSO wird das Ethyltriphenylphosponiumbromid mit Natriumhydrid deprotoniert.[5]
Es wird eine nach außen neutrale Phosphorverbindung gebildet, die man als Ylid oder Phosphoran bezeichnet. Diese Betaine lassen sich aber auch als Ylen formulieren. Andere gängige Deprotonierungsreagenzien sind Phenyllithium oder n-Butyllithium.
Eine Moderne und einfache Methode zur Deprotonierung des Phosphoniumions unter Lithium-freien Bedingungen ist die Verwendung von Kalium-tert.-Butylat in THF oder bei sterisch gehinderten Carbonyl-Gruppen in Toluol.[6]. Dabei kann das Wittig-Salz trocken in equimolaren Verhältnissen mit der Base vermengt werden und mit dem Lösungsmittel versetzt werden was eine einfacher zu handhabende Alternative zu dem Instant-Ylid[7] darstellt.[8].
Phosphor-Ylide lassen sich auch durch Carbenaddition an Phosphine erhalten.[9]Mechanismen der Wittig-Reaktion
Übersichtsartikel
- E. Vedejs et al, Topics in Stereochemistry 1994, 21, 1. ISBN 978-0-471-52120-4[10]
- Thomas Laue und Andreas Plagens Namens- und Schlagwortreaktionen der organischen Chemie, 5. Auflage, Vieweg+Teubner-Verlag 2006, ISBN 3-8351-0091-2 [11]
Wittig-Reaktion, stereochemische Aspekte
Insgesamt ist der genaue Mechanismus noch nicht genau geklärt, bzw. er läuft je nach Substituenten verschieden ab. Zum Großteil läuft die Reaktion mehrstufig ab; einzelne Zwischenverbindungen lassen sich isolieren. Bei reaktiven Yliden/Carbonyl-Verbindungen erfolgt der Angriff des Carbanions und Bildung des Oxaphosphetans konzertiert nach den Woodward-Hoffmann-Regeln.[12] Es gibt ebenfalls Hinweise, dass in Gegenwart von sehr großen Substituenten (hohe sterische Hinderung), die Reaktion über radikalische Stufen (SET single electron transfer) verläuft.[13]
Bereits bei der Bildung des Betains wird festgelegt, ob das Alken E- oder Z-konfiguriert ist. Der erste Schritt ist jedoch teilweise reversibel.
- Bei reversibler Addition wird in diesen Fällen das thermodynamisch stabilere Additionsprodukt gebildet (thermodynamische Reaktionskontrolle).
- Bei irreversibler Addition wird das Produkt gebildet, das sich schneller bildet (niedrigere Aktivierungsenergie; kinetische Reaktionskontrolle).[14]
Schon kurz nach der Entdeckung erkannte man, dass die Wittig-Reaktion meist recht diastereoselektiv verläuft. Ja nach Reaktivität der eingesetzten Ylid/Carbonyl-Komponenten kann die Diastereoselektivität durch Wahl der Substituenten (sowohl am Ylid als auch an der Carbonylverbindung) und den Reaktionsbedingungen das Ausbeuteverhältnis der Isomeren gezielt verändert werden[15]. Da die Reaktivität des Carbonyls in der Regel gegeben ist, versucht man die Diastereoselektivität durch die Anpassung der Reaktivität des Ylids zu beeinflussen. Generell gilt:
E/Z-Produkte in Abhängigkeit von den Reaktivitäten Reaktivität der Carbonylverbindung hoch mittel niedrig Reaktivität
des
Ylideshoch Z Z E/Z mittel Z E/Z E/Z niedrig E E E Möglichkeiten der Variation der Reaktivität des Oxaphosphetan
Die Stabilisierung kann durch Ersatz der Substituenten am Phosphor mit π/σ-Donatoren erfolgen. Es entstehen dann meist mit hohen Ausbeuten die E-Olefine.
Die Destabilisierung kann durch Ersatz der Substituenten am Phosphor mit π/σ-Akzeptoren erfolgen. Es entstehen dann meist mit hohen Ausbeuten die Z-Olefine.
mehrstufig (weniger reaktive Komponenten)
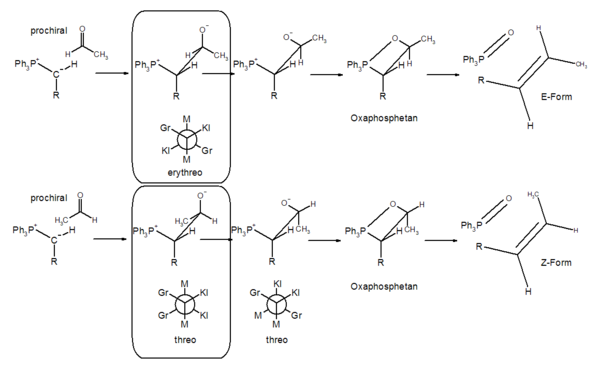
- 1.) Eingeleitet wird die Reaktion durch den Angriff des Carbanions an das positiv polarisierte Carbonyl-Kohlenstoff-Atom und der Bildung des Betains. Die Carbonyl-Verbindung ist in den meisten Fällen prochiral, d. h. bei der Betain-Bildung wird ein Chiralitätszentrum neu gebildet, das je nach Angriffseite (pro-R, bzw. pro-S) R- oder S-konfiguriert ist.
Das Carbanion des Ylides ist ebenfalls prochiral. Es kommt also intermediär zur Bildung einer Verbindung, die zwei benachbarte chirale C-Atome enthält. Je nach Art der Anordnung der Substituenten kommt es zu zwei unterschiedlichen Formen, die sich auf die Kohlenhydrate Threose und Erythrose zurückführen lassen. Zur Benennung ordnet man die Substituenten nach Größe. Ergibt sich eine Konformation (durch Rotation um die C-C-Achse) in der sich die großen, mittleren und kleinen Substituenten jeweils gegenüber stehen, spricht man von der erythro-Form, alternativ von der threo-Form. Das Durchlaufen der Betain-Zwischenstufe konnte durch Isolierung stabiler Vertreter nachgewiesen werden.[11]
- 2.) Das Betain reagiert über das Konformere, das eine thermische [2+2]-Cyloaddition zum cyclischen Oxaphosphetan ermöglicht. Die Existenz des Vierring-Intermediates konnte durch 31P-NMR-Spektroskpopie nachgewiesen werden.[16], [10] Das bei −80 °C gebildete Oxaphosphetan ist bei diesen Temperaturen stabil.[17] Beim Erwärmen auf 0 °C zersetzt es sich.
- 3.) Durch eine retro-[2+2]-Cycloaddition kommt es zur Ausbildung von Triphenylphosphinoxid und dem (E)-Alken.
konzertiert (reaktivere Komponenten)
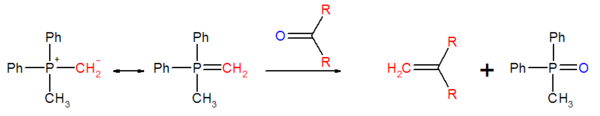
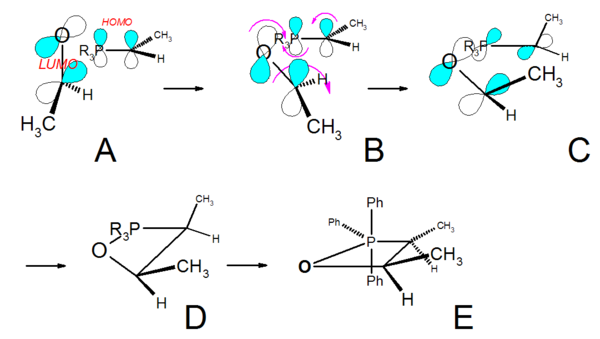
Bei nicht stabilisierten Yliden verläuft die Reaktion schnell. Durch Coulomb-Anziehung nähern sich die Reaktanten orthogonal (A, jeweils die positiv polarisierten Atome lagern sich an jeweils negativ geladenen an). Gleichzeitig erfolgt aus sterischen Gründen, dass die „großen“ Methylgruppen sich weitmöglichst voneinander positionieren. Die Bindungsbildung erfolgt durch Torsion des Übergangkomplexes (B, C) und konzertierter [2s+2a]-Cycloaddition (disrotatorischer Ringschluss)).[18] Die Betain-Zwischenstufe wird quasi übersprungen.
Über einen „verdrillten“ Vierring (twisted, D) bildet sich schließlich das Z-Oxaphosphetan E.
Nebenreaktionen
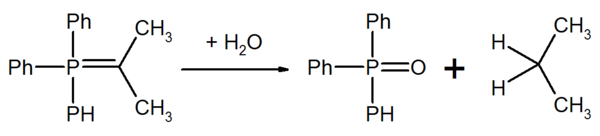
Nicht stabilisierte Ylide sind labil gegenüber Sauerstoff und Wasser. Durch Hydrolyse entsteht aus einem Ylid ein Phosphinoxid und ein Kohlenwasserstoff.
Durch Teilumsetzung mit Sauerstoff (oder durch Zugabe von Oxiadtionsmitteln) kann man einen Teil des Ylids zur Carbonylverbindung reoxidieren. Diese Carbonylverbindung reagiert mit einem weiteren Ylid zu einem Alken.
Gewöhnlich sind diese Nebenreaktionen unerwünscht und ausbeutevermindernd, weshalb man unter Inertgas und Feuchtigkeitsausschluss arbeitet. Teilweise werden diese Reaktionen aber auch präparativ genutzt.[19]
enantioselektive Wittig-Reaktionen
Durch Verwendung chiraler Phosphorliganden erzielten Trost und Curran[20] in einer intramolekularen Wittigreaktion einen Enatiomerenüberschuss (ee) von 30–40 %. Siehe dort.
wittig-ähnliche Reaktionen
mit anderen Carbonyl- und Heterocarbonyl-Verbindungen
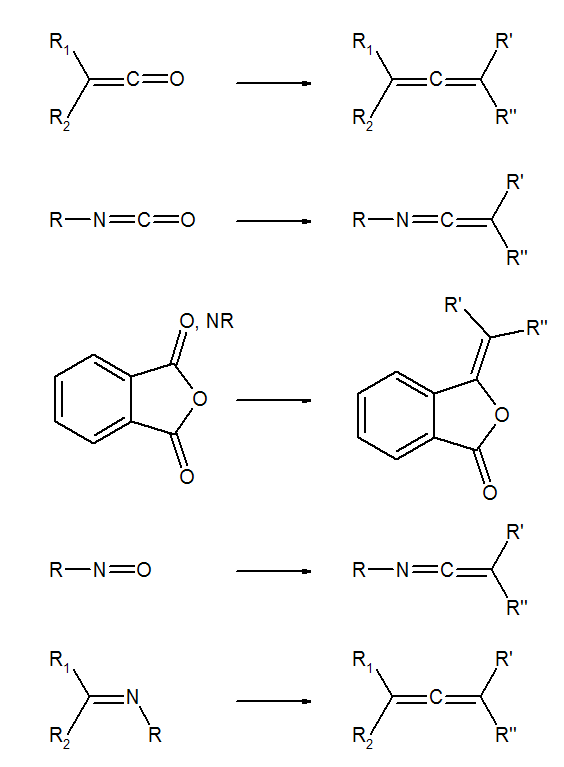
Phosphor-Ylide reagieren in ähnlicher Weise auch mit anderen C=O-Bindungen, beispielsweise mit Ketenen,[21] mit Isocyanten,[22] mit verschiedenen Anhydriden und Iminen.[23][24][25][26]
Arsen-Ylide
Das Homologe des Phosphors bildet wie dieses quartäre Arsonium-Salze, die sich ebenfalls mit Basen in α-Stellung deprotonieren lassen. Diese Arsen-Yylide verhalten sich bei der Carbonyl-Olefinierung wie Stickstoff-Ylide. [27]
Beispiele
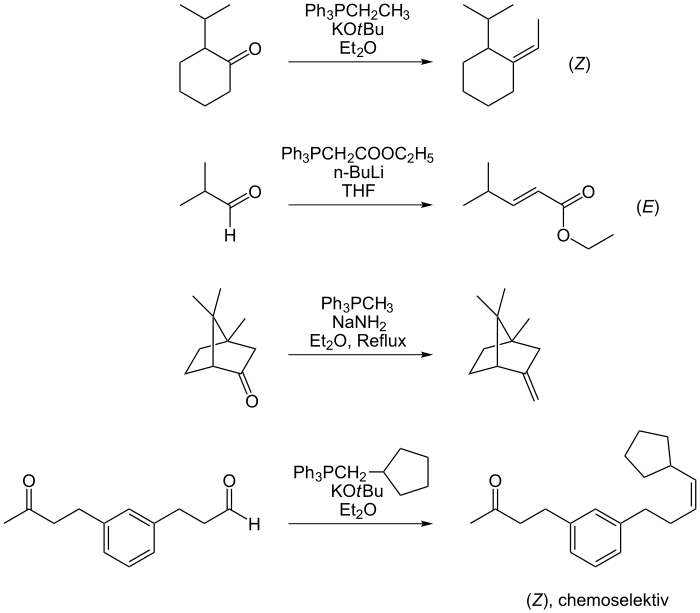
Die Vielseitigkeit der Wittig-Reaktion wird in Bild 2 an einigen Beispielen gezeigt.
Grenzen der Wittig-Reaktion
Ein Nachteil der Wittig-Reaktion ist ihre Beschränkung auf Aldehyde und Ketone (Ausnahmen siehe oben). Carbonsäurederivate sind quasi inert gegenüber Yliden. Die Wittig-Reaktion erfordert weiterhin basische Bedingungen, die Nebenreaktionen wie Eliminierungen oder Racemisierungen initiieren können. Alternative Olefinierungsreagenzien sind beispielsweise in Titanocen-Verbindungen (siehe Tebbe-Reaktion).
Alternativen der Wittig-Reaktion
Peterson-Olefinierung, die Julia-Olefinierung und die Tebbe-Reaktion. Ferner die Metathese.
Varianten
- Wittig-Horner-Reaktion
- Horner-Wadsworth-Emmons-Reaktion
- Schlosser-Variante der Wittig-Reaktion
Einzelnachweise
- ↑ Wittig G.; Geissler G.: Liebigs Ann. Chem. 580, 44, (1953)
- ↑ Wittig G.; Schöllkopf U.: Über Triphenyl-phosphin-methylene als olefinbildende Reagenzien. Ber. d. Dt. Chem. Ges. 87(9):1318–1330, (1954)
- ↑ Wittig G.; Pommer H.: DBP 954247, 1956
- ↑ Wittig G.; Pommer H.: Chem. Abstr. 1959, 53, 2279
- ↑ a b Heinz G. Becker u.a. (Hrsg.): Organikum. Organisch-chemisches Grundpraktikum. Wiley-VCH, Weinheim 2004, ISBN 3-527-31148-3
- ↑ L. Fitjer, U. Quabeck: In Chem. Commun. 1985, 15, 855 – 864
- ↑ M. Schlosser, B. Schaub: In Chimia 36, 1982, 396-397.
- ↑ D. Spitzner, K. Oesterreich: In Eur. J. org. Chem. 10, 2001, 1883-1886
- ↑ Jerry March, Advanced Organic Chemistry, McGraw-Hill Kogakusha 1977, ISBN 0-07-040247-7
- ↑ a b E. Vedejs et al, Topics in Stereochemistry 1994, 21, 1. ISBN 978-0-471-52120-4
- ↑ a b Thomas Laue und Andreas Plagens Namens- und Schlagwortreaktionen der organischen Chemie, 5. Auflage, Vieweg+Teubner-Verlag 2006, ISBN 3-8351-0091-2
- ↑ Robert B. Woodward, Roald Hoffmann: Die Erhaltung der Orbitalsymmetrie, Verlag Chemie, Weinheim, 1-178, 1970, ISBN 3-527-25323-8
- ↑ Kaim, W., Nachr. Chem. Tech. Lab. 1984, 32, 436–439
- ↑ Peter Sykes: Reaktionsmechanismen der Organischen Chemie 7. Auflage, Verlag Chemie 1979, ISBN 3-527-21047-4
- ↑ Schlosser M.; Christmann K.F.: Liebigs Ann. Chem. 708. (1967) 1.
- ↑ B.E. Maryanoff et al., J. Am. Chem. Soc. 1986, 108, 7664-7678
- ↑ Streitwieser/Heathcock Organische Chemie, Verlag-Chemie 1980, ISBN 3-527-25810-8
- ↑ Nguyên Trong Anh: Die Woodward-Hoffmann-Regeln und ihre Anwendung, Verlag Chemie 1970, ISBN 3-527-25430-7
- ↑ H.J. Bestmann, R. Armsen, H. Wagner, Chem. Ber. 1969, 102 2259-2269
- ↑ Trost, B.M. and Curran, D.P., J. Am. Chem. Soc. 1980, 102, 5699
- ↑ Asknes und Frøyen, Acta Chem. Scand. 1968, 22 2347
- ↑ Frøyen, Acta Chem. Scand., Serie B 1974, 28 568
- ↑ Chopard, Hudson und Searle, Tetrahedron Lett. 1965, 2357
- ↑ Flitsch und Peters, Tetrahedron Lett. 1969, 1161
- ↑ Gara, Massy-Westropp und Reynolds, Tetrahedron Lett. 1969, 4171.
- ↑ Bestmann und Seng, Tetrahedron 21 1965, 1373.
- ↑ Holleman-Wiberg Lehrbuch der Anorganischen Chemie, 81–90. Auflage, Walter de Gruyter-Verlag 1978, ISBN 3-11-005962-2
Weblinks
Wikimedia Foundation.