- Zitronensalz
-
Strukturformel 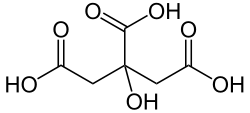
Allgemeines Name Citronensäure Andere Namen - Zitronensäure
- 2-Hydroxypropan-1,2,3-tricarbonsäure
- 2-Hydroxypropyl-1,2,3-tricarbonsäure
- 3-Carboxy-3-hydroxyglutarsäure
- 2-Hydroxy-1,2,3-propantricarbonsäure
- E 330
- INCI-Bezeichnung: Citric Acid
Summenformel C6H8O7 CAS-Nummer 77-92-9 (wasserfrei)
5949-29-1 (Monohydrat)PubChem 311 ATC-Code A09AB04
Kurzbeschreibung farbloser, geruchloser Feststoff [1] Eigenschaften Molare Masse 192,13 g·mol−1 Aggregatzustand fest
Dichte 1,67 g·cm−3 (18 °C) [1]
Schmelzpunkt Siedepunkt Zersetzung: ab 175 °C [1]
pKs-Wert Löslichkeit Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Reizend (Xi) R- und S-Sätze R: 36 S: 26 Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln LD50 3000 mg·kg−1 (Ratte, oral) [3]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Citronensäure (auch Zitronensäure, systematisch nach IUPAC: 2-Hydroxypropan-1,2,3-tricarbonsäure) ist eine farblose, wasserlösliche Carbonsäure, die zu den Fruchtsäuren zählt. Mit dem Begriff Citrat bezeichnet man ein Salz der Citronensäure, sowie das darin enthaltene Anion, also die deprotonierte Form.
Neben der wasserfreien Variante existiert das Citronensäuremonohydrat (C6H8O7 · H2O), das pro Molekül Citronensäure ein Molekül Kristallwasser enthält.
Inhaltsverzeichnis
Geschichte
Citronensäure wurde 1784 von Carl Wilhelm Scheele erstmals aus dem Saft der Zitrone – daher der Name – isoliert. Allerdings dürfte Citronensäure schon den ersten Alchemisten bekannt gewesen sein, wenn auch unter anderem Namen. Bereits im 9. Jahrhundert soll der arabische Alchemist Dschābir ibn Hayyān (Geber) Citronensäure entdeckt haben.
Vorkommen
Citronensäure ist eine der am weitesten verbreiteten Säuren im Pflanzenreich und tritt als Stoffwechselprodukt in allen Organismen auf. Zitronensaft enthält beispielsweise 5–7 % Citronensäure. Sie kommt aber auch in Äpfeln, Birnen, Sauerkirschen, Himbeeren, Johannisbeeren, in Nadelhölzern, Pilzen, Tabakblättern, im Wein und sogar in der Milch vor.
Diese Verbreitung kommt daher, dass die Citronensäure als namengebendes Zwischenprodukt im sog. Citratzyklus (auch Tricarbonsäurezyklus, Krebszyklus) auftritt, der eine Schlüsselrolle im Kohlenhydrat- und Fettsäure-Stoffwechsel aller sauerstoffverbrauchenden Lebewesen einschließlich des Menschen einnimmt. Dieser Zyklus liefert auch die molekularen Grundstrukturen für den Aufbau der meisten Aminosäuren.
Gewinnung und Darstellung
Herstellung aus Zitrusfrüchten
Nach dem ursprünglichen Verfahren wurde Citronensäure aus Zitrusfrüchten gewonnen: Zitronensaft wird mit konzentrierter Ammoniaklösung versetzt, eingedickt und filtriert. Das leicht lösliche Ammoniumcitrat durch Fällung mit Calciumchlorid in schwerer lösliches Calciumcitrat umgewandelt. Die Lösung wird erneut filtriert und der Filterkuchen in 25%-iger Schwefelsäure gelöst, wobei noch schlechter lösliches Calciumsulfat (Gips) ausfällt. Nach erneuter Filtration wird eine Citronensäurelösung gewonnen. Die reine Citronensäure erhält man durch Kristallisation.
Biotechnische Herstellung
Citronensäure wird heutzutage industriell mit Hilfe einer transgenen Variante des Schimmelpilzes Aspergillus niger gewonnen. Hierfür braucht es hauptsächlich drei Bedingungen:
- Hoher Glucose- und Sauerstoffgehalt im Nährmedium
- Niedriger pH-Wert (pH < 3). Dieser bewirkt zum einen, dass das Folgeenzym der Citratsynthetase im Citratzyklus, die Aconitase, gehemmt wird. Ein solch niedriger pH-Wert liegt fern des pH-Optimums des Enzyms und dadurch sinkt dessen Aktivität stark ab. Dies führt dazu, dass die gebildete Citronensäure von den Pilzen nur in geringem Maße weiter verstoffwechselt wird. Zum anderen wird die Außenmembran der Pilzzellen instabil und die Citronensäure wird in das Außenmedium abgegeben. Hinzu kommt, dass die Kontaminationsgefahr durch unerwünschte Fremdorganismen bei derart niedrigem pH-Wert niedrig ist.
- Niedrige Fe2+-Konzentration (< 5 mg/l). Dadurch fehlt der Aconitase der Cofaktor. Die Fe2+-Ionen werden durch Zugabe von Kaliumhexacyanidoferrat(III) gebunden.
Eigenschaften
Citronensäure bildet im wasserfreien Zustand rhombische Kristalle, die leicht sauer schmecken. In geringen Mengen eingenommen fördert Citronensäure indirekt das Knochenwachstum, weil sie die Aufnahme von Calcium begünstigt. In größeren Mengen wirkt sie jedoch toxisch (LD50 bei Ratten: 3 g/kg).
Citronensäure wird aufgrund ihrer drei Carboxylgruppen (–COOH) zu den organischen Tricarbonsäuren gezählt. Zudem weist die Hydroxylgruppe (–OH) an Position 3 des Kohlenstoffrückgrates sie als Hydroxycarbonsäure aus.
Eine wässrige Lösung der Citronensäure leitet den elektrischen Strom, da die Carboxylgruppen Protonen abspalten und somit bewegliche Ladungsträger (Ionen) in der Lösung vorliegen. Die drei Säuredissoziationskonstanten der Citronensäure sind pKs1 = 3,14, pKs2 = 4,76 und pKs3 = 6,39. Der teilweise beziehungsweise vollständig dissoziierte Säurerest der Citronensäure wird als Citrat bezeichnet.
Chemische Eigenschaften
Citronensäure kann viele Reaktionen eingehen, die für Carbonsäuren beschrieben werden, unter anderem
Citronensäure kann mit verschiedenen Oxidationsmitteln (beispielsweise Peroxiden oder Hypochloriten) oxidiert werden. In Abhängigkeit von den Reaktionsbedingungen können dabei β-Ketoglutarsäure, Oxalsäure, Kohlendioxid und Wasser entstehen.
Verwendung
Citronensäure wirkt nicht nur durch die saure Wirkung kalklösend, sondern auch durch Bildung eines Calcium-Komplexes und wird oft in Reinigungsmitteln eingesetzt. Damit wird der unangenehme Geruch von Essigreinigern vermieden. Allerdings sind die Komplexe nicht hitzebeständig und zerfallen beim Erhitzen zu relativ schwer löslichem Calciumcitrat. Citronensäure kann beispielsweise für die Entkalkung von Wasserkochern, Tauchsiedern, Wasserhähnen, Duschköpfen oder von Geschirrspülern oder Waschmaschinen verwendet werden.
Citronensäure und ihre Salze werden zur Konservierung und als Säuerungsmittel von Lebensmitteln verwendet, beispielsweise in Getränken. In Brausepulver und -stäbchen ist sie zusammen mit Natriumhydrogencarbonat enthalten. Citronensäure wird insbesondere in Limonaden und Eistee verwendet, kommt aber in Fruchtsäften auch natürlich vor. Die Citronensäure ist in der EU als Lebensmittelzusatzstoff der Nummer E 330 zugelassen. Sie wirkt auch als Peptisator und wird daher zur Herstellung von stabilen Suspensionen eingesetzt.
Wird durch gesäuerte Lebensmittel oder auch durch Säuren, die sich im Mund aus Zucker bilden können, der pH-Wert deutlich abgesenkt, so kann es zur Schädigung des Zahnschmelzes kommen (siehe Zahnkaries). Hierfür ist nicht speziell Citronensäure verantwortlich, sondern auch andere in Lebensmitteln verwendete oder natürlich vorhandene Säuren (z. B. Phosphorsäure, Ascorbinsäure und die Fruchtsäuren). Bei normaler Ernährung werden diese Säuren aber durch die Speichelinhaltsstoffe so abgepuffert, dass kein Schaden entsteht. Dagegen hat die Füllung von Babyflaschen mit gezuckertem Zitronentee durch Dauerbelastung zu verheerenden Zahnschäden bei mehreren Jahrgängen von Kleinkindern geführt, bis das Problem erkannt und abgestellt wurde. Citronensäure fördert die Aufnahme von Metallen wie Cadmium und Blei ins Blut.
Citronensäure und ihre Salze (Citrate) verhindern die Blutgerinnung. Deshalb konserviert man Blutspenden in Beuteln, die eine Citratpufferlösung enthalten. Auch verdünnt man das normalerweise dickflüssige Blut für Analysen mit Citratpuffer im Verhältnis Blut zu Citrat = 10 : 1. Eine spezielle Verwendung ist der Einsatz in Zellseparatoren. Dabei wird aus einer Vene Blut entnommen, im Gerät die gewünschten Blutbestandteile (zum Beispiel Thrombozyten) herausgefiltert und das restliche Blut in die Vene zurückgeführt. Damit das Blut im Gerät keine gefährlichen Gerinnsel bildet, wird es mit Citratpuffer versetzt.
Citronensäure wird auch als Spüllösung bei Wurzelkanalbehandlungen in der Zahnmedizin verwendet.
Weitere Einsatzgebiete der Salze der Citronensäure:
- Citronensäure wird als Wasserenthärter und alternativer Weichspüler eingesetzt.
- Citronensäure wird zur Passivierung von Edelstahl eingesetzt. Bei diesem Verfahren werden die freien Eisenanteile aus der Edelstahloberfläche gelöst. Dadurch wird das Chrom-Eisen-Verhältnis positiv beeinflusst, das zu einer Verbesserung der Passivschicht und damit zur Verbesserung des Korrosionsschutzes von Edelstahl führt.
- Calciumcitrat-haltige Präparate werden von der Wellness-Industrie als Nahrungsergänzungsstoff angepriesen. Ähnliche Präparate werden auch Hunden zur Kräftigung von Gebiss und Knochen verabreicht.
- Magnesiumcitrat soll als Präparat oder als Nahrungsergänzung den Magnesiumspiegel im Körper erhöhen und so beispielsweise Wadenkrämpfen vorbeugen, sowie die allgemeine Leistungsfähigkeit steigern.
- Die Salze Trinatriumcitrat und Trilithiumcitrat werden in der Bauchemie – je nach zugesetzter Menge – als Verzögerer oder Beschleuniger für die Aushärtung zementärer Massen eingesetzt.
- Viele basische Arzneimittelwirkstoffe werden als Citrate dargereicht (beispielsweise Sildenafil-Citrat in Viagra).
- Citronensäure wird zur pH-Wert-Einstellung von Kosmetika, z.B. Hautpflegelotion oder -creme, verwendet[4][5]
Biologische Bedeutung
Citrat gilt als einer der wichtigsten Inhibitoren der Harnsteinbildung. Erhöhte Werte an Citrat im Urin senken also das Risiko der Bildung von Harnsteinen. Das im Urin ausgeschiedene Citrat stammt einerseits aus dem Stoffwechsel (Citratzyklus), andererseits wird es mit der Nahrung aufgenommen.
Einzelnachweise
- ↑ a b c d e f Eintrag zu Zitronensäure in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 2. Dezember 2007 (JavaScript erforderlich)
- ↑ a b c pKa Data Compiled by R. Williams
- ↑ Citric acid bei ChemIDplus
- ↑ Vollrath Hopp: Citronensäure: Beispiel für ein biotechnisches Produkt. in : Grundlagen der Life Sciences. 2000 Wiley-VCH Verlag, Weinheim, ISBN 9783527295609
- ↑ Professor Blumes Medienangebot: Citronensäure in der Kosmetik
Literatur
- Rolf D. Schmid: Taschenatlas der Biotechnologie und Gentechnik, 2. Auflage, Wiley-VCH Verlag, Weinheim 2006, ISBN 3-527-31310-9.
Weblinks
- Bundesinstitut für Risikobewertung – Hohe Gehalte an Citronensäure erhöhen das Risiko für Zahnschäden
Wikimedia Foundation.

