- Äthylenglycol
-
Strukturformel 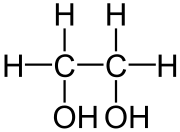
Allgemeines Name Ethylenglycol Andere Namen - Äthylenglykol
- EG
- 1,2- Dihydroxyethan
- 1,2-Ethandiol
- Ethan-1,2-diol
- Ethandiol
- Ethylenalkohol
- Ethylenoxidhydrat
- Genantin
- Glykol
- Glysantin
- Monoethylenglykol
Summenformel C2H6O2 CAS-Nummer 107-21-1 PubChem 174 Kurzbeschreibung farb- und geruchlose Flüssigkeit mit leicht süßlichem Geschmack, etwas viskoser als Wasser Eigenschaften Molare Masse 62,07 g·mol-1 Aggregatzustand flüssig
Dichte 1,11 g/cm3 [1]
Schmelzpunkt -16 °C [1]
Siedepunkt 197 °C [1]
Dampfdruck Löslichkeit mischbar mit Wasser [1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22 S: (2) MAK 10 ml/m3, 26 mg/m3 [1]
WGK 1 [1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. (Mono)Ethylenglycol (MEG) (Trivialname Glycol bzw. Glykol) ist der einfachste zweiwertige Alkohol mit der chemischen Bezeichnung Ethan-1,2-diol. Es ist also das einfachste Diol.
Die Bezeichnung Glycole wird darüber hinaus für Diole, die sich vom Ethylenglycol ableiten (sogenannte 1,2-Diole) verwendet. Beispiele sind Diethylenglycol (DEG), Triethylenglycol (TEG) oder die Polyethylenglycole.
Inhaltsverzeichnis
Gewinnung und Herstellung
Technisch wird Ethylenglycol aus Ethen oder aus Ethylenoxid hergestellt. Im OMEGA-Prozess wird Mono-Ethylenglycol mit hoher Selektivität (> 99%) über die Zwischenstufe des Ethylencarbonats hergestellt.
Verwendung
Großer Abnehmer für MEG sind die Hersteller von Polyester (PET), wo zusammen mit PTA in einer Polykondensation Polyesterschmelze hergestellt wird.[3]
Aufgrund der reduzierenden Eigenschaft der beiden OH-Gruppen kann es im Anlagenbau als Korrosionsschutzmittel in Kühlflüssigkeiten verwendet werden. Angeblich kommt es dabei auch der Wärmeleitfähigkeit zugute: Die Oberflächenspannung des Wassers wird gesenkt, es benetzt stärker und strömt leichter auch über zerklüftete Oberflächen. Ebenso besitzt es eine dielektrische Wirkung, die den Wärmetransport im Medium verbessern soll und wird daher vereinzelt als kostengünstiger Ersatz für spezielle Wärmeleiter eingesetzt. Dabei wird die elektrische Leitfähigkeit des Kühlmediums nicht signifikant gesteigert, da durch das Ethylenglycol keine Ionen gebildet werden.
Des Weiteren findet Ethylenglycol als Absorptionsmittel für die Entfernung von Wasserdampf aus Erd- und Raffineriegas oder Kreislaufgasen der Hydroraffination Anwendung.
In vielen akademischen Forschungsgruppen wird Ethylenglycol als Lösungsmittel und gleichzeitig als Reduktionsmittel für die Flüssigphasensynthese von eindimensionalen Metallnanostrukturen verwendet.
Sicherheitshinweise
Ethylenglycol ist als gesundheitsschädlich eingestuft. Die Hauptaufnahmewege sind das Verdauungssystem und die Haut, bei Ersterem kann mit einer sehr schnellen und nahezu vollständigen Resorption gerechnet werden. Ethylenglycol wirkt reizend auf Schleimhäute, vor allem des Auges. Bei hohen Dosen wirkt es zudem toxisch auf Nervengewebe, es kommt zu Herz-Kreislauf- und Stoffwechselstörungen und Nierenschädigung. Als minimale letale Dosis für den Menschen werden etwa 100 ml[1] und 1,4 g/kg Körpergewicht[2] angegeben, in Einzelfällen und mit optimaler medizinischer Therapie wurde auch die Aufnahme von ca. 1000 ml[1] Ethylenglycol überlebt.
Ethylenglycol zersetzt sich ab 165 °C und setzt dabei unter anderem Glycolaldehyd, Glyoxal, Acetaldehyd, Methan, Formaldehyd, Kohlenstoffmonoxid und Wasserstoff frei.
Antidot
Bei Vergiftungen steht mit Fomepizol, einem kompetitiven Hemmer der Alkoholdehydrogenase, ein Antidot zur Verfügung.
Siehe auch
Quellen
- ↑ a b c d e f g h i Eintrag zu CAS-Nr. 107-21-1 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 4. Januar 2008 (JavaScript erforderlich)
- ↑ a b Eintrag zu CAS-Nr. 107-21-1 im European chemical Substances Information System ESIS
- ↑ Bericht zur Weltmarktlage PTA & MEG 2007
Weblinks
Wikimedia Foundation.
