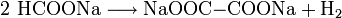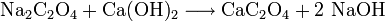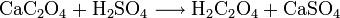- C2H2O4
-
Strukturformel 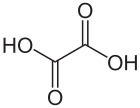
Allgemeines Name Oxalsäure Andere Namen - Ethandisäure
- Kleesäure
Summenformel C2H2O4 CAS-Nummer 144-62-7 (wasserfrei)
6153-56-6 (Dihydrat)Kurzbeschreibung farb- und geruchloser, kristalliner Feststoff [1] Eigenschaften Molare Masse 90,04 g·mol−1 Aggregatzustand fest
Dichte 1,9 g·cm−3 [1]
Schmelzpunkt Zersetzung: ab 157 °C [1]
pKs-Wert 1,23; 4,19 [1]
Löslichkeit löslich in Wasser: 220 g·l−1 (25 °C) [1], Ethanol
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 21/22 S: (2)-24/25 LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Oxalsäure (systematischer Name Ethandisäure) ist die einfachste Dicarbonsäure. Ihre Salze heißen Ethandioate, veraltet aber noch verbreitet: Oxalate. Oxalsäure ist auch ein Reduktionsmittel und kann daher quantitativ durch Titration mit einem Oxidationsmittel wie Kaliumpermanganat bestimmt werden, dabei entsteht Kohlenstoffdioxid als Oxidationsprodukt.
Inhaltsverzeichnis
Geschichte
Oxalsäure wurde 1769 durch Johann Christian Wiegleb im Sauerklee (Oxalis acetosella, daher der Name) als Kaliumsalz entdeckt und war daher erst unter dem Namen Kleesäure bekannt. 1776 konnte sie in größeren Mengen durch Carl Wilhelm Scheele und Torbern Olof Bergman durch Oxidation von Zucker mit Salpetersäure hergestellt werden, was noch keine Synthese, sondern der Abbau eines Naturstoffes war. (Auf dieses Verfahren geht auch der historische Name Zuckersäure, womit heute jedoch die Glucarsäure bezeichnet wird, zurück.) Oxalsäure wurde dann 1824 erstmalig von Friedrich Wöhler künstlich aus anorganischen Grundstoffen hergestellt (synthetisiert durch Verseifung von Dicyan, (CN)2).[4]
Vorkommen
Oxalsäure und ihr Kaliumsalz kommen in größeren Mengen in Rhabarber (180–765 mg/100 g Frischgewicht, Stiele) und anderen Knöterichgewächsen (Polygonaceen) vor, das meiste davon in den Blättern, weshalb nur der Stiel nach dem Kochen zum Verzehr geeignet ist. Auch Sternfrüchte (Averrhoa carambola) enthalten viel Oxalsäure (40–1000 mg/100 g Frischsubstanz). In ähnlichen Mengen kommt Oxalsäure aber auch in Sauerklee, Sauerampfer, Mangold (110–940 mg/100 g Frischgewicht), Spinat (120–1330 mg/100 g Frischgewicht), Petersilie (0–185 mg/100 g Frischgewicht), Kakao (338–480 mg/100 g), Schokolade (80–200 mg/100 g) und Roten Rüben (17–329 mg/100 g Frischgewicht) vor.
Gewinnung und Darstellung
Heutzutage wird Oxalsäure durch rasches Erhitzen von Natriumformiat auf 360 °C hergestellt.
Das erhaltene Natriumoxalat wird mit Calciumhydroxid in das schwerlösliche Calciumoxalat überführt, aus welchem die Oxalsäure mit Schwefelsäure freigesetzt wird.
Eigenschaften
Chemische Eigenschaften
Oxalsäure ist durch die Nachbarstellung der Carboxylgruppen eine starke Säure und wie die α-Diketone instabil. Sie zerfällt in konzentrierter Schwefelsäure sofort zu Kohlenstoffmonoxid, Kohlenstoffdioxid und Wasser. Oxalsäure kristallisiert aus wässrigen Lösungen mit 2 Molekülen Kristallwasser zum Oxalsäure-Dihydrat ((COOH)2 · 2 H2O). Oxalsäure und ihre löslichen Salze sind toxisch.
Verwendung
Oxalsäure kann zur Entfernung von Rostflecken verwendet werden. In der Technik wird sie oft als Hilfsstoff in der Elektrochemie (Eloxalverfahren) oder als Bleichmittel eingesetzt. Da in der Imkerei chemische Behandlungsmittel ein Tabu sein sollten, wird Oxalsäure, sowie Ameisensäure (Ameisensäure 60%ig oder 85%ig) und Milchsäure (Milchsäure 13%ig), als 3,2 % wässrige Lösung, oder direkt verdampft, zur Bekämpfung der Varroamilbe eingesetzt. Imker, die Oxalsäure gegen Varroose verwenden, sollten sich über mögliche Gefahren (Einatmung von Oxalsäurekristallen) genauestens informieren. Die weltweite Produktion von Oxalsäure und ihren Estern liegt bei 140.000 Tonnen pro Jahr.
Im analytischen Labor wird das Dihydrat der Oxalsäure als Urtitersubstanz für die Manganometrie verwendet. Weiterhin dient sie als Urtitersubstanz zur exakten Gehaltbestimmung von alkalischen Maßlösungen, etwa von Natronlauge. Durch die Bildung eines schwer löslichen Calcium-Salzes ist es außerdem zur gravimetrischen Bestimmung von Calcium-Ionen als Calciumoxalat von Bedeutung.
Im Fichtelgebirge wurde aus Sauerklee gewonnene Oxalsäure zum Bleichen von Quarz (Bergkristall) benutzt, welcher hier vorwiegend unter der Stadt Weißenstadt vorkommt.
In der Steinverarbeitung wird Oxalsäure (Kleesalz) zum Glanzpolieren von Marmor verwendet.
In der Holzbearbeitung dient Oxalsäure als mildere Bleiche (im Vergleich zum Wasserstoffperoxid) für Holz, wird aber vor allem in der Restaurierung von Möbeln verwendet, um eine gealterte Holzoberfläche zu verjüngen sowie zur Entfernung von Tinten-, Wasser- und Rostflecken im Holz, beispielsweise wenn beim Fügen von Brettern das Holz Kontakt mit stählernen Schraubzwinge bekommen hat[5][6].
In der Arzneistoff-Chemie wird die Oxalsäure als Salzbildner benutzt. Durch die Protonierung basischer Aminen entstehen so Oxalatsalze.
Biologische Bedeutung
Oxalsäure ist in höherer Konzentration giftig, kommt in geringer Konzentration aber auch in Lebensmitteln wie Tee (insbesondere schwarzer Tee und Pfefferminztee), in Rhabarber, in Kakao und Schokolade vor. Calciumoxalat entsteht in der Natur häufig beim Absterben von Pflanzenzellen. Es kann unter polarisiertem Licht in Form von hellen rechteckigen Kristallen erkannt werden (besonders einfach in braunen Zwiebelschalen). Nierensteine bestehen meist aus Calciumoxalat und Harnsäure, die Steinbildung wird aber durch Zitronensäure, welche in Früchten vorkommt, verhindert.
Da Oxalsäure die Resorption (Aufnahme) von Eisen im Darm erschwert, sollte man bei einer Eisentherapie, z. B. im Rahmen einer Eisenmangelanämie mit dem Verzehr der o. g. Lebensmittel zurückhaltend sein und diese auch nicht gleichzeitig mit der Einnahme von Eisentabletten zu sich nehmen. Nach Aufnahme von Oxalsäure kommt es im betroffenen Gewebe zu einer Verarmung an Calcium, in schweren Fällen kann dies eine Schädigung des Herzens zur Folge haben. Nach Aufnahme von größeren Dosen kann es zu Lähmungserscheinungen kommen, in jedem Fall (auch bei leichten Vergiftungen) kommt es zu Nierenschäden durch verstopfte Nierentubuli. Die letale Dosis (LDLo beim Menschen, oral) wird mit 600 mg/kg angegeben.[7]
Quellen
- ↑ a b c d e Eintrag zu Oxalsäure in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 2. Dez. 2007 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 144-62-7 im European chemical Substances Information System ESIS
- ↑ Oxalsäure bei ChemIDplus
- ↑ Burckhard Frank: 250 Jahre Chemie in Göttingen. In: Hans-Heinrich Voigt (Hrsg.): Naturwissenschaften in Göttingen. Eine Vortragsreihe. Vandenhoeck + Ruprecht Gm, Göttingen 1988, ISBN 3525358431 (Göttinger Universitätsschriften. Band 13), S. 72 ([1]und[2])
- ↑ David Charlesworth: Furniture-making Techniques, Vol. 2. Guild of Master Craftsmen Publications Ltd., Lewes (East Sussex, UK) 2001, ISBN 1861082959. (Seite 86)
- ↑ Declan O'Donoghue: The Complete Book of Woodworking. Lyons Press, London (UK) 2001, ISBN 159228177X. (Seite 94)
- ↑ Yakkyoku (1980). In: Pharmacy. Bd. 31, S. 959.
Weblinks
Wikimedia Foundation.