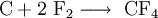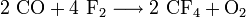- CF4
-
Strukturformel 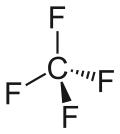
Allgemeines Name Tetrafluormethan Andere Namen - Tetrafluorkohlenstoff
- Kohlenstofftetrafluorid
- Freon 14
- Halon 14
Summenformel CF4 CAS-Nummer 75-73-0 Kurzbeschreibung geruch- und farbloses, erst bei über 1100° C brennbares Gas Eigenschaften Molare Masse 88,01 g·mol−1 Aggregatzustand gasförmig
Dichte 3,72 kg·m−3 (bei 15 °C, 1013 Millibar) [1]
Schmelzpunkt Siedepunkt −127,8 °C [2]
Löslichkeit schwer löslich in Wasser: 18,8 mg·l−1 (25 °C) [3]
Sicherheitshinweise Gefahrstoffkennzeichnung [4] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze GWP 7390 (bezogen auf 100 Jahre) [5] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Tetrafluormethan (veraltet Tetrafluorkohlenstoff) ist eine chemische Verbindung aus der Reihe der Fluorkohlenwasserstoffe und stellt das vollständig fluorierte Methan dar.
Inhaltsverzeichnis
Eigenschaften
 Kalottenmodell von Tetrafluormethan
Kalottenmodell von TetrafluormethanTetrafluormethan ist ein farb- und geruchloses Gas mit einem Schmelzpunkt von −186,6 °C und einem Siedepunkt von −127,8 °C. Tetrafluormethan ist in Wasser sehr schlecht (20 mg pro kg Wasser bei 20 °C[6]) löslich, in Ethanol (ca. 80 mg pro kg Ethanol bei 25 °C[7]) und Benzol (ca. 64 mg pro kg Benzol bei 25 °C[8]) etwas besser. Tetrafluormethan ist sehr reaktionsträge und wird von Säuren und Laugen nicht angegriffen, eine Ausnahme stellt die explosionsartige Reaktion mit Alkalimetallen dar. Durch thermische Zersetzung entstehen giftige Stoffe (Carbonylfluorid, Kohlenstoffmonoxid), in Gegenwart von Wasser auch der aggressive Fluorwasserstoff.
Außerdem besitzt es ein Treibhauspotenzial von 7390[5] und ist damit ein extrem starkes Treibhausgas.
Herstellung
Tetrafluormethan kann einerseits durch Verbrennung von Kohlenstoff in Fluor, andererseits durch elektrische Entladung in einem Kohlenstoffmonoxid-Fluorgemisch dargestellt werden:[9]
Verwendung
Tetrafluormethan wird als Kältemittel zum Ersatz von FCKWs verwendet, da es keine abbauende Wirkung auf die Ozonschicht hat. Aufgrund des hohen Treibhauspotenzials jedoch wird in der F-Gase-Verordnung festgelegt, dass Anlagen mit den entsprechenden Gasen möglichst geringe Leckmengen abgeben sollen.
Toxikologie
Tetrafluormethan gilt als ungiftig. Es kann jedoch in geschlossenen Räumen durch Verdrängen der Luft zur Erstickung führen. Bei geringeren Konzentrationen ist eine narkotische Wirkung möglich.[4]
Quellen
- ↑ Datenblatt bei airliquide
- ↑ a b Eintrag zu Tetrafluormethan in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 13. Dezember 2007 (JavaScript erforderlich)
- ↑ Tetrafluormethan bei ChemIDplus
- ↑ a b Sicherheitsdatenblatt airliquide
- ↑ a b P. Forster, P., V. Ramaswamy et al.: Changes in Atmospheric Constituents and in Radiative Forcing. In: Climate Change 2007: The Physical Science Basis. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge University Press, Cambridge und New York 2007, S. 212, (PDF)
- ↑ Cosgrove B.A., Walkley J., J. Chromatogr., 216, 161–167, 1981
- ↑ Bo S., Battino R., Wilhelm E., J. Chem. Eng. Data, 38(4), 611–616, 1993
- ↑ Archer G., Hildebrand J.H., J. Phys. Chem., 67, 1830–1833, 1963
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 203–4.
Weblinks
Wikimedia Foundation.