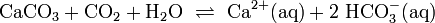- Ca(HCO3)2
-
Calciumhydrogencarbonat (auch: Calciumbicarbonat, theoretische Summenformel: Ca(HCO3)2, theoretische Molmasse: 162,11 g·mol−1), ist eine hypothetische Substanz. Es kann nicht als Reinsubstanz dargestellt werden, daher ist es auch nicht möglich, Stoffeigenschaften wie Schmelzpunkt u. ä. anzugeben.
Calciumhydrogencarbonat bildet sich bei der Verwitterung von Kalkstein, der im wesentlichen aus Calciumcarbonat besteht, durch die Einwirkung von Wasser und Kohlenstoffdioxid. Das Kohlenstoffdioxid verbindet sich mit Wasser zu Kohlensäure. Diese kann weiter zu Hydrogencarbonat dissoziieren und liefert dabei Wasserstoff-Ionen. Zugleich löst sich Calciumcarbonat in geringen Mengen im Wasser unter Freisetzung von Carbonat-Ionen. Diese übernehmen die von der Kohlensäure angebotenen Wasserstoff-Ionen und werden ebenfalls zu Hydrogencarbonat-Ionen. So stammt bei der kohlensauren Auflösung von Kalkstein jeweils ein Äquivalentanteil Hydrogencarbonat-Ionen aus der Kohlensäure, der andere aus dem Stein.
Um Calciumhydrogencarbonat in Lösung zu halten, ist eine bestimmte Konzentration an sogenannter „zugehöriger Kohlensäure“ vonnöten. Chemisch gesehen unterscheidet sich diese nicht von irgend einer anderen Kohlensäure; es geht nur um einen Mengenanteil. Diese zugehörige Kohlensäure stellt im Dissoziations-Gleichgewicht mit den vorhandenen Hydrogencarbonat-Ionen den pH-wert des Wassers gerade so niedrig ein, dass der von diesen pH-Wert wiederum abhängige Anteil an Carbonat-Ionen zusammen mit der vorhandenen Calcium-Konzentration gerade das Löslichkeitsprodukt von Calciumcarbonat noch nicht überschreitet.
Ist mehr als die zugehörige Menge an freier Kohlensäure in der Lösung vorhanden, nennt man diese Kohlensäuremenge „überschüssig“. Sie kann mit weiterem Kalkstein reagieren und ihn lösen. Der Mengenanteil davon, der weiteren Kalk löst und in das zusätzliche Calciumhydrogencarbonat eingeht, wird als „kalkaggressive Kohlensäure“ bezeichnet. Der Rest der überschüssigen Kohlensäure stockt dabei die zugehörige Kohlensäure auf das neue höhere Maß auf.
Calciumhydrogencarbonat existiert also nur in wässriger Lösung, als Koexistenz äquivalenter Mengen an Calcium- und Hydrogencarbonat-Ionen. Bei der Verdunstung des Wassers oder bei Erhitzen entweicht das Kohlendioxid aus der Lösung oder es vermindert sich durch Photosynthese. Dadurch verschiebt sich das Dissoziationsgleichgewicht der Kohlensäure wieder in Richtung auf einen steigenden Anteil der Carbonat-Ionen, d. h. in die linke Richtung der obigen Reaktionsgleichung. Somit wird das Löslichkeitsprodukt des Calciumcarbonats wieder überschritten und es bildet sich wieder unlöslicher Kalkstein. Dieser Vorgang liegt der Entstehung von Kalksinter, Travertin oder von Kalktuff zugrunde, aber auch von der Bildung von Kalksedimenten (Seekreide) in Seen und Ozeanen. Auch das im nördlichen Alpenvorland vorkommende, Nagelfluh genannte Konglomerat, (Sedimente der Molassen) kann so entstehen, indem Kies oder Schotter durch das Bindemittel Kalk zu einem Naturbeton verbacken wird.
Wasserwerke passen den Kohlensäuregehalt so an den Kalkgehalt des Trinkwassers an, dass sich in eisernen Rohrleitungen eine Kalkschicht ausbildet und erhalten bleibt, um das Rosten zu verhindern, die aber nicht zu dick werden darf, um den Leitungsquerschnitt nicht zu sehr zu vermindern. Bei dieser ständigen Anpassung spielt auch die Geschwindigkeit eine Rolle, mit der sich das obige Gleichgewicht einstellt: Mit reinstem Calciumcarbonat dauert dies außerordentlich lange; in Anwesenheit von Fremdionen (z. B. Mg++ oder SO4--) stellt sich das Gleichgewicht dagegen sehr rasch ein; deshalb wird Dolomit verwendet, um überschüssige Kohlensäure zu binden.
Der Calciumhydrogencarbonatgehalt des Leitungswassers bildet in der sogenannten Carbonathärte den Hauptbeitrag der Härte des Wassers.
Wikimedia Foundation.