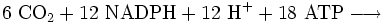- Calvin-Benson-Zyklus
-
Der Calvin-Zyklus ist eine zyklische Folge von chemischen Umsetzungen, durch die Kohlenstoffdioxid (CO2) zu Glucose und Wasser reduziert wird. Er dient den meisten photoautotrophen und chemoautotrophen Lebewesen zur Assimilation von Kohlenstoff aus Kohlenstoffdioxid. In Analogie zum Citrat-Zyklus wird der Calvin-Zyklus auch als "reduktiver Pentosephosphat-Zyklus" bezeichnet. Der Zyklus wurde von den US-amerikanischen Biochemikern Melvin Calvin und A. A. Benson entdeckt und nach Melvin Calvin benannt.
Als Reduktans für die CO2-Reduktion im Calvin-Zyklus dient NADPH, das dabei zu NADP+ oxidiert wird. Die Reduktion ist endergon, als Energiequelle dient ATP, das Energie abgibt, indem es in ADP und Phosphat gespalten wird.
Bei photoautotrophen Lebewesen werden NADPH und ATP durch die sogenannte Lichtreaktion gebildet und für den Calvin-Zyklus zur Verfügung gestellt. Bei chemoautotrophen Lebewesen werden NADPH und ATP durch die exergonen chemischen Umsetzungen ihres Energiestoffwechsels gebildet.
Bei photoautotrophen Lebewesen, zum Beispiel Pflanzen, bezeichnet man die reduktive Assimilation von Kohlenstoff aus CO2 unter Bildung von Glucose als Dunkelreaktion, weil für diesen Vorgang selbst kein Licht benötigt wird. (Allerdings wird für die Aktivierung der an den Reaktionen beteiligten Enzyme Licht benötigt. Dazu gehört nicht nur das Enzym Rubisco selbst, sondern auch Glycerinaldehyd-3-phosphat-Dehydrogenase, Fructose-1,6-bisphosphat-Phosphatase, Sedoheptulose-1,6-bisphosphat-Phosphatase, Sedoheptulose-1,7-bisphosphat-Phosphatase und Ribulose-5-phosphat-Kinase. In reiner Dunkelheit sind diese Enzyme also inaktiviert. Daher ist die Bezeichnung Dunkelreaktion veraltet.)
Der Calvin-Zyklus besteht aus mehreren zyklisch angeordneten enzymatischen Teilschritten und läuft bei Pflanzen im Stroma der Chloroplasten ab.
Inhaltsverzeichnis
Die Einzelschritte des Zyklus
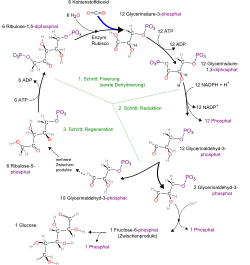
Der erste Schritt des Calvin-Zyklus besteht aus der Übertragung von CO2 durch das Enzym Rubisco auf Ribulose-1,5-bisphosphat als Akzeptormolekül. Die CO2-Gruppe wird an deren C-2-Atom addiert und es entsteht eine enzymgebundene, hypothetische 3-oxo-Säure (genau: 2-carboxy-3-keto-D-arabinit-1,5-bisphosphat, also eine Arabinit-Form) als Zwischenstufe, die durch Wasser (hydrolytisch) in zwei Moleküle der Triose-Vorstufe 3-Phosphoglycerat (3-PG) gespalten wird. Die Arabinit-Stufe erweist sich als höchst instabil und zerfällt spontan. Dies geschieht durch die Erzeugung eines Moleküls D-3-Phosphoglycerat (C3) und eines aus drei C-Atomen bestehenden Carbanions (ebenfalls C3) aus dem vorher genannten Arabinit (C6). Das Carbanion wird durch Protonierung ebenfalls in das primäre Fixierungsprodukt Phosphoglycerat überführt. Dadurch werden netto pro gebundenem Kohlenstoffdioxid zwei Phosphoglycerat - Moleküle erzeugt. Eines der beiden Produkte trägt den neu hinzufixierten Kohlenstoff des Kohlenstoffdioxids als Addenden. Dieselbe Verbindung/Verbindungen treten auch beim Auf- und Abbau der Glucose (Gluconeogenese bzw. Glykolyse) auf; im Calvin-Zyklus ist sie ein wichtiges Glied und ein Baustein zum Aufbau der Stärkespeicher.
Die folgenden Schritte auf dem Weg zur Stärke bzw. zur Saccharose werden durch die bekannten Gluconeogenese-Enzyme katalysiert. Zunächst wird dabei das eben gewonnene 3-Phosphoglycerat zu Glycerinaldehyd-3-phosphat (GAP) reduziert. Bei diesem Schritt wird Energie in Form von ATP benötigt. Die anschließenden Reaktionen von GAP zur Glucose benötigen keine weitere Zufuhr von Energie.
Das kurz vor dem Ende der Glucose-Bildung entstehende Glucose-6-phosphat bietet eine Möglichkeit, neues Ribulosebisphosphat zu bilden und damit den Kreislauf zu schließen (Phosphogluconatweg). Hier bietet der Pentosephosphat-Zyklus verschiedene Alternativen. Eine davon ist der Transaldolase-Transketolase-Weg, dessen Prinzip aus der Abbildung ersichtlich ist.
Summengleichung
Einzelne Reaktionen
- Erklärung der Abbildung:
- 1: CO2 wird durch das Schlüsselenzym Rubisco an Ribulose-1,5-bisphosphat (RuBP2) addiert; die hochgradig instabile Zwischenstufe zerfällt spontan in zwei Moleküle 3-Phosphoglycerat (3-PG), das erste fassbare Zwischenprodukt bei "C3-Pflanzen".
- 2: Nach Phosphorylierung und Reduktion durch eine spezielle Glycerinaldehyd-3-phosphat-Dehydrogenase (GAPDH; als Reduktans NADPH statt NADH) entsteht der Gluconeogenese-Metabolit Glycerinaldehyd-3-phosphat (GAP), ein wichtiger Verzweigungspunkt. Da in jedem Umlauf ein Molekül CO2 fixiert wird, steht nach jeweils drei Umläufen in der Bilanz ein Molekül der Triose GAP für Biosynthesen zur Verfügung, und zwar entweder
- zur Bildung des als Reservestoff dienenden Polysaccharids Stärke im Stroma der Chloroplasten von Pflanzen oder
- nach Ausschleusen über die Zwíschenstufe Dihydroxyacetonphosphat (DAP) und im Gegentausch zu anorganischem Phosphat (Pi) zur cytosolischen Synthese des Disaccharids Saccharose (Rohrzucker; siehe unten).
- 3: Im eigentlichen Calvinzyklus erfolgt der Ringschluss über den Transaldolase-Transketolase-Weg (3A), in dem aus fünf C3-Bausteinen (GAP) drei C5-Bausteine (Xylulose-5-phosphat, X-5P) gebildet werden (Disproportionierung). Aus X-5P kann dann durch Epimerisierung (3B) und Phosphorylierung das Akzeptormolekül Ribulose-1,5-bisphosphat regeneriert werden. Wie beim Schema der Photorespiration, in dem O2 statt Kohlenstoffdioxid fixiert wird, enthält das Formelschema einige Vereinfachnungen. Stöchiometrische Angaben in rot.
Kohlenhydratbildung bei Pflanzen
Nach jeweils drei Durchläufen des Calvin-Zyklus kann in der Bilanz ein Molekül Glycerinaldehyd-3-phosphat (GAP) aus dem Calvin-Zyklus für weitere Synthesen abgezweigt werden. Ein zentrales Produkt der Assimilation im Chloroplasten von Pflanzen ist Stärke, die sich in Form von Granula (Stärkekörnern) zunächst im Stroma ablagert. Aus diesem Zwischenspeicher werden bei Bedarf Kohlenhydrate in Form von Triosephosphaten freigesetzt, die dann im Cytoplasma zum Disaccharid Saccharose umgesetzt werden. Saccharose ist die wichtigste Transportform von Kohlenhydraten, die durch die Siebröhren des Phloems in Speicherorgane aus nicht photosynthetisch aktiven Zellen (Wurzeln, Knollen, Mark) gelangt. Dort bilden sich erneut Stärkekörner (Stärke-Granula) in Formen, die für die Pflanze und das Gewebe charakteristisch sind (kugelig, oval, linsen-, spindel-, oder stabförmig; siehe Stärke).
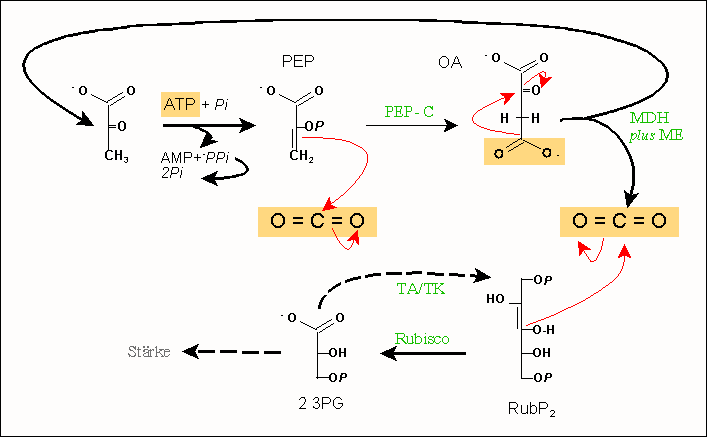
Wie unter Photorespiration ausgeführt, ist dieser Weg beim normalen CO2-Partialdruck der Luft ineffizient. C4-Pflanzen unterstützen die Reaktion daher durch eine "ATP-getriebene CO2-Pumpe":
- Katalysiert durch Pyruvat-Phosphat-Dikinase und unter ATP-Aufwand entsteht als primärer CO2-Akzeptor aus Pyruvat(Pyr) Phosphoenolpyruvat (PEP; siehe unten). Nach Carboxylierung durch PEP-Carboxylase wird daraus Oxalacetat (OA). Diese C4-Verbindung wird in einer besonderen Malatschleuse durch zwei Malatdehydrogenasen transportiert und weiter umgesetzt
- in der regulären Malatdehydrogenase (MDH)-Reaktion entsteht Malat, das im Rahmen des Hatch-Slack-Zyklus in einen benachbarten Zelltyp transportiert wird;
- dieser Zelltyp verfügt über das Malatenzym (ME), welches OA in einer Form liefert, die spontan zu Pyruvat und CO2 zerfällt. Dabei entsteht CO2 mit einem Partialdruck, bei dem Nebenreaktionen unterdrückt werden.
Abbildung: Kohlenstoffdioxidfixierung durch Phosphoenolpyruvat bzw. Ribulose-1.5-bisphosphat
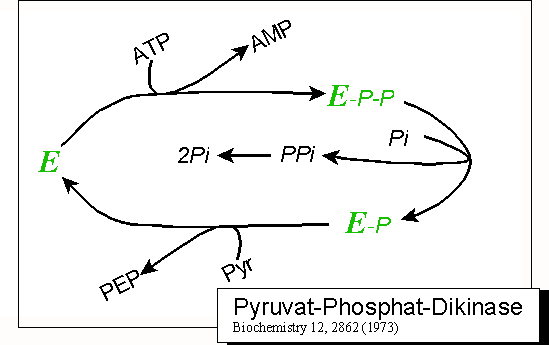
Pyruvat-Phosphat-Dikinase
Die Umsetzung von Phosphoenolpyruvat in Pyruvat, eine Reaktion der Glycolyse, ist so exergon, dass sie in umgekehrter Richtung nicht direkt (d.h. durch Aufwenden nur eines Moleküls ATP) durchlaufen werden kann. Zu diesem Zweck entstanden unterschiedliche Strategien, die jeweils zwei energiereiche Anhydridbindungen ins Spiel bringen (vergl. Gluconeogenese). In Chloroplasten wird zu diesem Zweck Pyruvat-Phosphat-Dikinase eingesetzt. Dieses Enzym hat die ungewöhnliche Eigenschaft, eine Phosphatgruppe durch ATP-Hydrolyse (zu AMP) zu aktivieren. Mechanistisch geschieht dies durch Übertragung eines Pyrophosphatrestes auf das Enzym und dessen nachfolgende Phosphorolyse nach folgendem Schema:
Abbildung: Synthese von Phosphoenolpyruvat aus Pyruvat: Reaktionszyklus der Pyruvat-Phosphat-Dikinase
Siehe auch
Weblinks
Wikimedia Foundation.