- Cardiazol
-
Strukturformel  Strukturformel von (+)-Campher
Strukturformel von (+)-Campher
Allgemeines Name Campher Andere Namen - Kampfer,
- 1,7,7-Trimethyl-bicyclo[2.2.1]heptan-2-on
- Bornan-2-on
Summenformel C10H16O CAS-Nummer - 76-22-2 [(±)-Campher]
- 464-49-3 [(+)-Campher]
- 464-48-2 [(−)-Campher]
ATC-Code C01EB02
Kurzbeschreibung farbloser Feststoff Eigenschaften Molare Masse 152,24 g·mol−1 Aggregatzustand fest
Dichte 0,99 g·cm-3 [(±)-Campher] [1]
Schmelzpunkt Siedepunkt 209 °C [(±)-Campher][1]
Dampfdruck Löslichkeit unlöslich in Wasser[1], gut in Ethanol, Petrolether, Aceton und Chloroform
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 

Leicht-
entzündlichReizend (F) (Xi) R- und S-Sätze R: 11-36/37/38 S: keine S-Sätze Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln MAK 13 mg/m3, 2 ml/m3[1]
WGK 1[1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Campher bzw. Camphora (fachsprachlich, standardsprachlich: Kampfer) ist ein farbloser Feststoff. Er ist ein bicyclisches Monoterpen-Keton und leitet sich formal vom Camphan ab. Es gibt zwei Enantiomere des Camphers, (+)-Campher und (−)-Campher beziehungsweise D- und L-Campher. Die Struktur wurde von Julius Bredt aufgeklärt.
Campher ist in Europa seit der Spätantike (5. Jahrhundert) unter dem griechischen Namen kaphoura (καφουρά) bekannt, der auf Sanskrit karpura bzw. Prakrit kappura zurückgeht. Der indische Name wiederum entstand durch Entlehnung aus einer austronesischen Sprache Sumatras.
Inhaltsverzeichnis
Vorkommen
Campher findet sich hauptsächlich in den ätherischen Ölen von Lorbeergewächsen, Korbblütlern und Lippenblütlern. Besonders in der Rinde beziehungsweise im Harz des Campherbaums, eines immergrünen Baums, der hauptsächlich in Asien wächst, ist er zu finden.
Eigenschaften
Campher ist ein farbloses oder weißes, meist krümeliges und brockig zähes Pulver aus wachsweichen Kristallen. Mit Ethanol können rhomboedrische Kristalle erzeugt werden. Beim Abschrecken geschmolzenen Camphers bilden sich kubische Kristalle. Campher hat einen charakteristischen, starken, wohlriechenden, aromatisch-holzigen, eukalyptusartigen Geruch. Der Geschmack ist scharf und bitter, auch leicht kühlend wie bei Menthol. Er schmilzt bei 177 °C und siedet bei 207 °C. In Wasser ist das Pulver kaum löslich (1,2 g pro Liter Wasser); in Ethanol hingegen löst es sich gut. Außerdem ist es sehr leicht löslich in Petrolether, leicht löslich in Ether, Aceton, Chloroform und in fetten Ölen und sehr schwer löslich in Glycerol. Es bildet mit Ethanol farblose Lösungen, aus denen sich, wenn Wasser hinzugegeben wird, das Campher wieder abscheidet. Die Dichte beträgt 0,96 g/cm³. Campher ist leicht flüchtig und sublimiert schon bei Zimmertemperatur. Er verbrennt mit rußender Flamme. Der Flammpunkt liegt bei 74 °C, die Zündtemperatur bei 466 °C. Zwischen einem Luftvolumenanteil von 0,6 und 3,5 % bildet er explosive Gemische. Beim Campher tritt das Phänomen der molaren Schmelzpunkterniedrigung auf: Die Gefrierpunkterniedrigung beträgt 39,7 °C·(kg/mol). So verflüssigt sich Campher bereits, wenn es in Kontakt mit Menthol, Naphthol oder Chloralhydrat kommt. Der spezifische Drehwinkel beträgt +48 °.
Sicherheitshinweise
Campher wirkt auf das Zentrale Nervensystem und die Niere, in höheren Dosen auch auf das Atemzentrum. Er ist durchblutungsfördernd und schleimlösend, führt aber auch zu Übelkeit, Angst, Atemnot und Aufgeregtheit. In Überdosis oral eingenommen kommt es zu Verwirrtheits- und Dämmerzuständen, Depersonalisation, extremen Déjà-vu-Erlebnissen, Panik und akuten tiefgreifenden Störungen des Kurzzeitgedächtnisses bis hin zu Amnesie und epileptischen Anfällen. Die tödliche Dosis für einen Erwachsenen liegt bei circa 20 g. Der Metabolismus geht zunächst zum vom Campher abgeleiteten Alkohol 2-Borneol, welcher in der Leber weiter zum Glucuronid umgewandelt wird. Dieses wird schließlich über den Harn ausgeschieden[2].
Campher ist schwach wassergefährdend (WGK 1).
Verwendung
 Der Campherbaum
Der CampherbaumCampher wird in Feuerwerkskörpern, teilweise in Sprenggelatine und in Mottenabwehrmitteln verwendet. Außerdem wird er für die Celluloidproduktion und als Weichmacher für Celluloseester verwendet. In geringen Mengen wird er in Kosmetik- und Medizinpräparaten benutzt, zum Beispiel bei Muskelzerrungen, Rheuma oder Neuralgien, in Mitteln gegen Erkältungen, in der Zahnmedizin zur Desinfektion von infizierten Wurzelkanälen; früher wurde er auch als Analeptikum verwendet, heute jedoch seltener wegen der Wirkungen auf das Herz und den Kreislauf.
Seltene Fälle der Verwendung von Campher als Rauschmittel sind bekannt. Die Wirkungen beim Inhalieren von Campher zeigen sich in Lachanfällen trotz Schmerzen in den Atemwegen. Campher findet noch Verwendung in Schnupftabak aus England, wohingegen er in Deutschland laut deutschem Lebensmittelgesetz zu den in Tabak verbotenen Stoffen zählt und nicht hinzugefügt werden darf.
In der Bienenpflege findet Campher als von der EU zugelassener Wirkstoff gegen Milbenbefall eine Anwendung. Auch in Sturmglasbarometern findet er Verwendung. Allein oder in Verbindung mit Baumharzen und/oder anderen Stoffen wird er als Räucherwerk beim Räuchern verwendet.
Pharmakologische Eigenschaften und Anwendungen
Kampfer ist das älteste Analeptikum. Analeptika steigern in geeignetem Dosisbereich die Aktivität bestimmter Abschnitte des Zentralnervensystems. Die pharmakologische Anwendung von Kampfer wird heute als obsolet bezeichnet. Die früher übliche Anwendung von Pentetrazol (Cardiazol ®) in der Krampfbehandlung von Geisteskrankheiten erlebte einen Höhepunkt um 1938. Die Bezeichnung der Cardiazolschockbehandlung ist im Schrifttum der Geschichte der Psychiatrie noch heute gebräuchlich.[3] [4]
Gewinnung und Darstellung
Campher kann synthetisch hergestellt werden, aber auch durch Wasserdampfdestillation und Kristallisation aus zerkleinerten Pflanzenteilen gewonnen werden. Natürlicher Campher ist meistens rechtsdrehend ((+)-Campher, "Japancampher". In Matricariaarten findet sich aber auch linksdrehender (-)-Campher ("Matricariacampher")[5]. Heutzutage wird Campher technisch von α-Pinen aus synthetisiert. Über das intermediäre Carboniumion entsteht dabei ein Racemat [1:1-Gemisch aus (+)- und (−)-Campher].
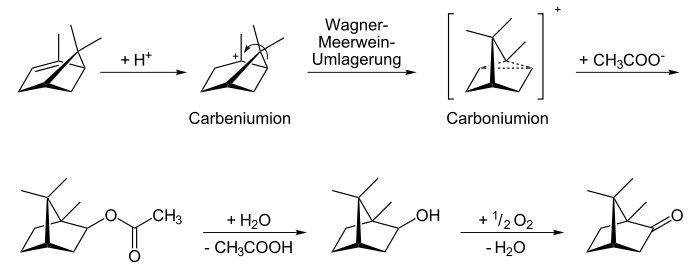 α-Pinen wird protoniert; durch Wagner-Meerwein-Umlagerung wird es zum Carboniumion umgelagert. Dieses reagiert mit Natriumacetat zu Isobornylacetat, welches anschließend zum Isoborneol hydrolysiert und zum Schluss zum Campher oxidiert wird.
α-Pinen wird protoniert; durch Wagner-Meerwein-Umlagerung wird es zum Carboniumion umgelagert. Dieses reagiert mit Natriumacetat zu Isobornylacetat, welches anschließend zum Isoborneol hydrolysiert und zum Schluss zum Campher oxidiert wird.Quellen
- ↑ a b c d e f g h Eintrag zu CAS-Nr. 76-22-2 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 08.01.2008 (JavaScript erforderlich)
- ↑ Auterhoff-Knabe-Höltje: Lehrbuch der pharmazeutischen Chemie. Wissenschaftliche Verlagsgesellschaft Stuttgart 1999 ISBN 3-8047-1645-8
- ↑ Kuschinsky, G. und H. Lüllmann: Pharmakologie. Georg Thieme, Stuttgart - 3. Auflage 1967, Seite 170 f.
- ↑ Linde, Otfried K.: Pharmakopsychiatrie im Wandel der Zeit. Erlebnisse und Ergebnisse. Tilia-Verlag Klingenmünster 1988; Seite 112 f. Textauszug:„Der Enthusiasmus, der in einem extrem kurzen Zeitraum des vierten Dezenniums unseres Jahrhunderts fast gleichzeitig mehreren Erschütterungstherapien zum therapeutischen Durchbruch verholfen hat, löste bei vielen Menschen Reflexionen über die Zusammenhänge von Medizin, Kultur und Politik aus.“
- ↑ Römpp CD 2006, Georg Thieme Verlag 2006
Weblinks
Wikimedia Foundation.

-Campher.png)