- Carter-Goddard-Malrieu-Trinquier-Modell
-
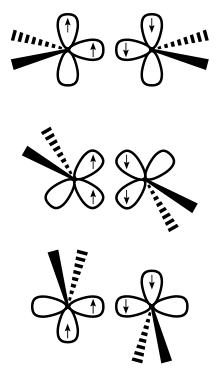
Das Carter-Goddard-Malrieu-Trinquier-Modell ist ein Modell aus der anorganischen Chemie. Es dient zur Beschreibung und Voraussage von Verzerrungen in Mehrfachbindungssystemen von Hauptgruppenelementen. Spaltet man in einem System R1R2M=MR3R4 die Doppelbindung homolytisch, so können die beiden entstehenden carbenanalogen Fragmente anschließend sowohl in einem Singulett- als auch einem Triplettzustand vorliegen. Unabhängig davon kann der Grundzustand der Fragmente jedoch ein Triplett- oder ein Singulettzustand sein.
E. A. Carter und W. A. Goddard III konnten zeigen, dass sich die Bindungsenergie EG aus der Bindungsdissoziationsenergie Eint abzüglich der Summe der Singulett-Triplett-Anregungsenergien ΣΔES->T der entstehenden Fragmente ergibt. EGBE = Eint − ΣΔES->T.
Dieses Modell erweiterten G. Trinquier und J. P. Malrieu um die Möglichkeit, aufgrund von ΣΔES->T Aussagen über die Geometrie (charakterisiert durch den Abstand der Metallzentren r, und des Verkippungswinkelswinkels θ) eines Doppelbindungssystems zu treffen. Wie in der Illustration zu ersehen, ist für Triplettfragmente eine coplanare Struktur (θ = 0°) optimal. Für Singulettfragmente ergibt sich dagegen eine doppelte Donor-Akzeptor-Bindung mit einem Winkel von θ nahe 45°.
Literatur
- Matthias Driess, Hansjörg Grützmacher, Angew. Chem. 1996, 108, 900–929.
- Christoph Widauer: Ab Initio Study of Neutral and Cationic Double Bond Systems Containing Group 15 Elements, Dissertation ETH Zürich, 2000, doi:10.3929/ethz-a-004036588, S. 4–8.
Wikimedia Foundation.