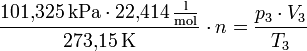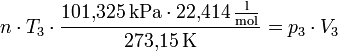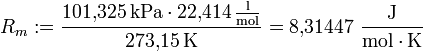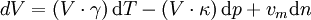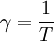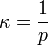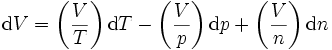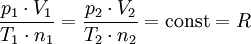- Charlessches Gesetz
-
Die thermische Zustandsgleichung idealer Gase, auch kurz als ideale, universelle oder allgemeine Gasgleichung bzw. als Gasgesetz bezeichnet, beschreibt das Verhalten und die Eigenschaften eines idealen Gases exakt. Sie vereint alle experimentellen Einzelergebnisse und die hieraus abgeleiteten Gasgesetze zu einer allgemeingültigen Zustandsgleichung.
Inhaltsverzeichnis
Allgemeine Zustandsgleichung
Die allgemeine Zustandsgleichung beschreibt den Zustand des idealen Gases bezüglich der Zustandsgrößen Druck p, Volumen V, Temperatur T und Stoffmenge n bzw. Teilchenzahl N bzw. Masse m. Die Gleichung kann in verschiedenen, zueinander äquivalenten Formen formuliert werden, wobei alle diese Formen den Zustand des betrachteten Systems in gleicher Weise und eindeutig beschreiben.
Extensive Formen:
Intensive Form:Hierbei stehen die einzelnen Formelzeichen für folgende Größen:
- kB - Boltzmannkonstante
- Rm - universelle oder molare Gaskonstante
- Rs - individuelle oder spezielle Gaskonstante
- ρ - Dichte
- vm - molares Volumen
- v - spezifisches Volumen
- N - Teilchenzahl
- n - Stoffmenge
- M - Molare Masse
- T - Temperatur (in Kelvin)
Die ideale Gasgleichung stellt den Grenzfall aller thermischen Zustandsgleichungen für verschwindende Dichte
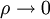 dar, das heißt für verschwindenden Druck bei genügend hoher Temperatur. In diesem Fall kann man das Eigenvolumen der Gasmoleküle und die Kohäsion – die anziehende Kraft zwischen den Molekülen – vernachlässigen.
dar, das heißt für verschwindenden Druck bei genügend hoher Temperatur. In diesem Fall kann man das Eigenvolumen der Gasmoleküle und die Kohäsion – die anziehende Kraft zwischen den Molekülen – vernachlässigen.Die ideale Gasgleichung ist für viele Gase wie zum Beispiel wasserdampfungesättigte Luft auch bei Normalbedingungen eine gute Näherung. Aus der idealen Gasgleichung folgt, dass die Innere Energie eines Idealen Gases unabhängig von Druck und Volumen ist und nur von der Temperatur abhängt. Sie besteht nur aus der kinetischen Energie der Wärmebewegung der Moleküle.
Im Jahr 1873 erweiterte Johannes Diderik van der Waals das Gasgesetz zur Van-der-Waals-Gleichung, die das Eigenvolumen der Gasteilchen und die Anziehung zwischen ihnen im Gegensatz zur allgemeinen Gasgleichung mit berücksichtigt und somit auch als Näherung auf deutlich reale Gase angewendet werden kann. Eine andere Näherungslösung für reale Gase stellt die Reihenentwicklung der Virialgleichungen dar, wobei die allgemeine Gasgleichung identisch mit einem Abbruch der Reihenentwicklung nach dem ersten Glied ist. Generell gilt, dass die allgemeine Gasgleichung als Näherungslösung für schwach reale Gase bei geringen intermolekularen Wechselwirkungen, kleinen Drücken und hohen Temperaturen (großen Molvolumina) geeignet ist. Insbesondere weisen ideale Gase hierbei keinen Joule-Thomson-Effekt auf.
Spezialfälle
Es gibt verschiedene Spezialfälle des allgemeinen Gasgesetzes, welche einen Zusammenhang zwischen zwei Größen herstellen, während alle anderen Größen konstant gehalten werden. Erklärt und nicht nur empirisch abgeleitet werden diese Zusammenhänge zwischen den Zustandsgrößen eines Gases durch dessen Teilchencharakter, also durch die kinetische Gastheorie.
Gesetz von Boyle-Mariotte
Das Gesetz von Boyle-Mariotte, auch Boyle-Mariottesches Gesetz oder Boyle-Mariotte-Gesetz und oft mit Boyle'sches Gesetz abgekürzt, sagt aus, dass der Druck idealer Gase bei gleichbleibender Temperatur und gleichbleibender Stoffmenge umgekehrt proportional zum Volumen ist. Erhöht man den Druck auf ein Gaspaket, wird durch den erhöhten Druck das Volumen verkleinert. Verringert man den Druck, so dehnt es sich aus. Dieses Gesetz wurde unabhängig von zwei Physikern entdeckt, dem Iren Robert Boyle (1662) und dem Franzosen Edme Mariotte (1676): (isotherm)
Für T = const und n = const gilt:
Gesetz von Gay-Lussac
Das erste Gesetz von Gay-Lussac, auch Gay-Lussacsches Gesetz, Gesetz von Charles oder Charlessches Gesetz, besagt, dass das Volumen idealer Gase bei gleichbleibendem Druck und gleichbleibender Stoffmenge direkt proportional zur Temperatur ist. Ein Gas dehnt sich also bei einer Erwärmung aus und zieht sich bei einer Abkühlung zusammen. Dieser Zusammenhang wurde 1787 von Jacques Charles und 1802 von Joseph Louis Gay-Lussac erkannt.
Für p = const und n = const gilt:
Das eigentliche Gesetz von Gay-Lussac (obiges ist nur der Teil, den man meist als das Gesetz von Charles bezeichnet) lautet:
Hierbei ist T0 die Temperatur am Nullpunkt der Celsiusskala, also 273,15 K oder 0 °C. Demhingegen ist T die gesuchte Temperatur, wobei man darauf achten muss, die gleiche Einheit wie bei T0 zu verwenden. Analog ist V das Volumen bei T, V0 das Volumen bei T0 und γ0 der Volumenausdehnungskoeffizient bei T0, wobei für ideale Gase allgemein γ = 1/T gilt.
Aus dieser Gleichung kann man folgern, dass es einen absoluten Temperaturnullpunkt geben muss, da die Gleichung für diesen ein Volumen von Null voraussagt und das Volumen nicht negativ werden kann. Ihre empirische Basis ist daher auch Grundlage für die absolute Temperaturskala Kelvins, da hierüber durch Extrapolation der Temperaturnullpunkt bestimmt werden konnte.
Gesetz von Amontons
Das Gesetz von Amontons, oft auch 2. Gesetz von Gay-Lussac, sagt aus, dass der Druck idealer Gase bei gleichbleibendem Volumen und gleichbleibender Stoffmenge direkt proportional zur Temperatur ist. Bei einer Erwärmung des Gases erhöht sich also der Druck und bei einer Abkühlung wird er geringer. Dieser Zusammenhang wurde von Gay-Guillaume Amontons entdeckt.
Für V = const und n = const gilt:
Analog zum Gesetz von Gay-Lussac gilt hierbei auch:
Gesetz der Gleichförmigkeit
Das Gesetz der Homogenität sagt aus, dass ein ideales Gas durch und durch homogen, das heißt gleichförmig, ist, dass es also überall dieselbe Dichte hat. Wenn in einem großen Behälter mit einem homogenen Stoff, zum Beispiel mit einem Gas, an einer Stelle eine Teilmenge V1 eingeschlossen wird, so enthält diese dieselbe Stoffmenge wie eine Teilmenge mit demselben Volumen V1 an anderer Stelle. Teilt man die gesamte Stoffmenge auf zwei gleichgroße Volumina auf, so enthalten sie die gleiche Stoffmenge, nämlich die Hälfte der ursprünglichen. Daraus folgt:
Die Stoffmenge ist bei gleichbleibendem Druck und gleichbleibender Temperatur proportional zum Volumen, oder umgekehrt:
Das Volumen ist bei gleichbleibendem Druck und gleichbleibender Temperatur proportional zur Stoffmenge.
Für T = const und p = const gilt:
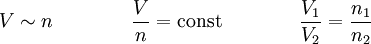 .
.
Diese Gesetze gelten für alle homogenen Stoffe, solange Temperatur und Druck unverändert bleiben, und eben auch für ideale Gase.
Gesetz von Avogadro
Das Gesetz von Avogadro sagt aus, dass zwei gleich große Gasvolumina, die unter demselben Druck stehen und die dieselbe Temperatur haben, auch dieselbe Teilchenzahl einschließen. Dies gilt sogar dann, wenn die Volumina verschiedene Gase enthalten. Selbstverständlich gilt es auch für den Fall, dass die Zusammensetzung in den beiden Volumina gleich ist; deswegen folgt auch aus dem Gesetz von Avogadro die Beziehung V ~ n für T = const und p = const. Darüber hinaus bedeutet es aber auch, dass ein Gaspaket in einem bestimmten Volumen auch eine bestimmte Anzahl von Teilchen hat, die unabhängig von der Stoffart ist. Allerdings gibt es gewisse Ausnahmen, wenn zum Beispiel weniger oder zu viele Teilchen in einem Gaspaket sind.
Das Gesetz von Avogadro wurde 1811 durch Amedeo Avogadro entdeckt.
Es kann auch so formuliert werden: Das molare Volumen ist bei einer bestimmten Temperatur und bei einem bestimmten Druck für alle idealen Gase identisch. Messungen haben ergeben, dass ein Mol eines idealen Gases bei 0 °C = 273,15 K und 1013,25 hPa Druck ein Volumen von rund 22,4 dm³ einnimmt.
Eine sehr bedeutende Folge des Gesetzes ist: Die Gaskonstante ist für alle idealen Gase identisch.
Herleitungen
Herleitung aus der kinetischen Gastheorie
Die kinetische Gastheorie besagt, dass sich Gase aus vielen einzelnen Atomen bzw. Molekülen zusammensetzen, die jedes für sich eine Masse m und eine Geschwindigkeit v haben. Die mittlere kinetische Energie aller Teilchen ist der Temperatur des Gases proportional. Es gilt:
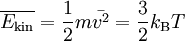 ,
,
wobei
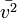 die mittlere quadratische Geschwindigkeit der Teilchen ist. Man sieht, dass sich die Moleküle, bei höherer Temperatur des Gases, mit höheren Geschwindigkeiten bewegen. Dabei besitzen nicht alle Teilchen die gleiche Geschwindigkeit, sondern es tritt eine statistische Verteilung der Geschwindigkeiten auf (Maxwell-Boltzmann-Verteilung).
die mittlere quadratische Geschwindigkeit der Teilchen ist. Man sieht, dass sich die Moleküle, bei höherer Temperatur des Gases, mit höheren Geschwindigkeiten bewegen. Dabei besitzen nicht alle Teilchen die gleiche Geschwindigkeit, sondern es tritt eine statistische Verteilung der Geschwindigkeiten auf (Maxwell-Boltzmann-Verteilung).Ist das Gas in einem Behälter mit dem Volumen V eingeschlossen, so stoßen immer wieder Gasmoleküle gegen die Wand des Behältnisses und werden reflektiert. Dadurch übertragen die Teilchen pro Zeiteinheit und pro Wandfläche einen bestimmten Impuls auf die Wand. Es wirkt mit den Teilchenstößen auf jeden Teil der Wand eine Kraft, die wir als den Gasdruck p begreifen.
Dieser Druck p ist umso größer, je schneller die Teilchen sind. Zum einem steigt bei hohen Teilchengeschwindigkeiten die Rate, mit der die Gasmoleküle auf die Wand treffen, da sie den Behälterraum schneller durchqueren. Zum anderem werden die Stöße gegen die Wand heftiger und es wächst der dabei übertragene Impuls. Wird die Teilchendichte N / V erhöht, so wächst die Wahrscheinlichkeit, mit der Moleküle an die Wand stoßen. Aus solchen Überlegungen kann man diese Gleichung für den Druck herleiten:
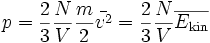 .
.
Drückt man die mittlere kinetische Energie der Gasteilchen durch die Temperatur aus, so ergibt sich daraus die ideale Gasgleichung:
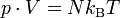 .
.
Diese Gleichung gilt jedoch nur bei Gasen mit geringer Teilchendichte und bei genügend hoher Temperatur. Bei dieser Herleitung wird nämlich vernachlässigt, dass Anziehungskräfte zwischen den Teilchen wirken, die den Teilchendruck gegen die Wand abschwächen. Außerdem besitzen die Moleküle selbst ein Volumen und das Gas kann nicht beliebig komprimiert werden, weil die Teilchen sich gegenseitig verdrängen. Die Beschreibung eines solchen realen Gases bewältigt die van-der-Waals-Gleichung.
Herleitung aus den Spezialfällen
Die Kombination der Gesetze von Amontons und Gay-Lussac
Die Gesetze von Amontons und Gay-Lussac, welche beide zeitlich vor der Gasgleichung gefunden wurden, lassen sich beispielsweise durch das Gedankenexperiment einer zweistufigen Zustandsänderung zusammenfassen, wobei man hierbei generell von einer gleichbleibenden Stoffmenge ausgeht.
Zunächst betrachtet man eine isochore Zustandsänderung nach dem Gesetz von Amontons. Der Ausgangspunkt ist hierbei der Zustand 1 mit p1, V1 und T1. Endpunkt ist Zustand 2 mit p2, V2 (=V1) und T2.Es folgt eine isobare Zustandsänderung nach dem Gesetz von Gay-Lussac von Zustand 2 nach Zustand 3 mit p3 (=p2), V3 und T3.
Setzt man nun den Ausdruck für T2 aus obiger Gleichung in den Ausdruck für T2 aus unterer Gleichung ein und stellt um, wobei man p3 = p2 und V2 = V1 berücksichtigen muss, so erhält man als Resultat die Beziehung:
Eigentliche Herleitung der Gasgleichung
Als letzten Schritt muss man die Konstante im rechten Term des obigen Ausdrucks ermitteln. Geht man davon aus, dass ein Mol bei 273,15 Kelvin und 101,325 Kilopascal genau 22,414 Liter einnimmt, also das Gesetz von Avogadro gültig ist, so kann man auch davon ausgehen, dass n Mol eines idealen Gases genau n · 22,414 Liter einnehmen. Wenn man dies in obige Gleichung einsetzt, erhält man:
Multipliziert man die Gleichung mit T3 und isoliert gleichzeitig das n aus dem Bruch, so erhält man:
Der linke Bruch ist eine konstante Zahl, man definiert diese als die Gaskonstante R und berechnet dessen Zahlenwert.
Streicht man nun die Indizes, so erhält man die gesuchte allgemeine Gasgleichung:
Herleitung aus der thermischen Zustandsgleichung
Grundlage für die Herleitung ist die thermische Zustandsgleichung:
Hierbei stehen die einzelnen Formelzeichen für folgende Größen:
- κ - Kompressibilität
- γ - Volumenausdehnungskoeffizienten
- vm - molares Volumen (vm = V/n)
Bei einem idealen Gas gilt speziell:
Hierdurch wird die thermische Zustandsgleichung zu folgender Form vereinfacht:
Man kann die Zustandsgleichung nun von einem Zustand 1 zu einem Zustand 2 integrieren (bestimmtes Integral) und erhält dadurch:
Gleichen sich zwei der Zustandsgrößen, haben sie sich also vom Zustand 1 zum Zustand 2 nicht geändert, so können diese gekürzt werden und man erhält dadurch die jeweiligen Spezialfälle. Die universelle Gaskonstante R muss hierbei experimentell bestimmt werden und leitet sich nicht aus der Integrationskonstante ab. Einen beispielhaften Versuchsaufbau kann man im Artikel der Gaskonstante nachlesen.
Weblinks
Wikimedia Foundation.

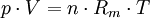
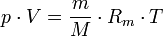
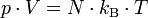
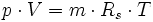
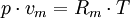
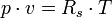
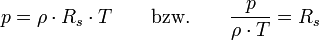
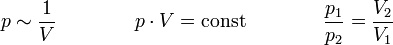
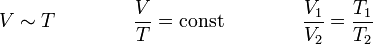
![V(T) = V_0 \left(1 + \gamma_0 [T - T_0]\right) \qquad \text{mit} \qquad \gamma_0 = \frac{1}{T_0} = \frac{1}{273{,}15\ \mathrm{K}}](/pictures/dewiki/57/90e8b90b804dcbc55d70f7f07b2bdfca.png)
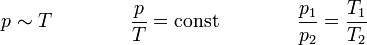
![p(T) = p_0 \left(1 + \gamma_0 [T - T_0]\right) \!](/pictures/dewiki/52/4935808e112b4a9acee4bbeb5218fa9d.png)