- Abstrahlungsspektrum
-
Ein Emissionsspektrum ist das elektromagnetische Spektrum, das von Atomen, Molekülen oder Materialien ausgestrahlt wird, ohne dass elektromagnetische Strahlung gleicher Frequenz eingestrahlt wird. Das Gegenstück eines Emissionsspektrums bildet das Absorptionsspektrum.
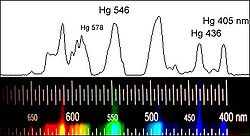 Zwei Darstellungen des Emissionsspektrums einer Hochdruck-Quecksilberdampflampe; die Zahlen geben die Wellenlänge (in nm) der Spektrallinien des Quecksilbers an. Weitere Banden tragen keine Zahlen - dies sind die Emissionen der durch die UV-Strahlung des Quecksilber-Plasmas angeregten Leuchtstoffe.
Zwei Darstellungen des Emissionsspektrums einer Hochdruck-Quecksilberdampflampe; die Zahlen geben die Wellenlänge (in nm) der Spektrallinien des Quecksilbers an. Weitere Banden tragen keine Zahlen - dies sind die Emissionen der durch die UV-Strahlung des Quecksilber-Plasmas angeregten Leuchtstoffe.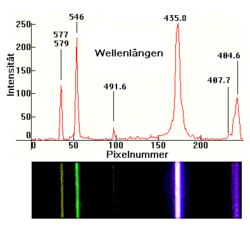 Zwei Darstellungen des Spektrums einer Niederdruck-Quecksilberdampflampe. Obere Aufnahme mit einem 256-Pixel-Zeilensensor. Untere Aufnahme mit einer Kamera
Zwei Darstellungen des Spektrums einer Niederdruck-Quecksilberdampflampe. Obere Aufnahme mit einem 256-Pixel-Zeilensensor. Untere Aufnahme mit einer Kamera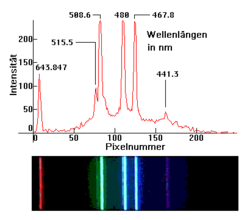 Zwei Darstellungen des Spektrums einer Niederdruck-Cadmiumdampflampe. Obere Aufnahme mit einem 256-Pixel-Zeilensensor. Untere Aufnahme mit einer Kamera
Zwei Darstellungen des Spektrums einer Niederdruck-Cadmiumdampflampe. Obere Aufnahme mit einem 256-Pixel-Zeilensensor. Untere Aufnahme mit einer KameraAtomspektrum
Ein Atomspektrum ist das Emissionsspektrum eines einzelnen isolierten Atoms, also die Intensität des von ihm ausgesandten (emittierten) Lichts als Funktion der Wellenlänge (oder Frequenz). Die Spektrallinien entsprechen jeweils der Energiedifferenz zwischen zwei verschiedenen Zuständen des Atoms. Diese Energiedifferenz wird beispielsweise durch ein absorbiertes Lichtteilchen, ein Photon, aufgebracht und dann in Form eines Photons, mit jener Energie, abgegeben, d.h. emittiert. Diese ist daher diskret, kann also nicht beliebige Werte annehmen, was auch bedingt, dass jedes Atom - entsprechend seiner Elektronenkonfiguration - nur diskrete Wellenlängen emittieren kann. Die emittierten Wellenlängen sind daher spezifisch für ein bestimmtes Element und den Anfangs- und Endzustand.
Ein Vergleich der beiden oberen Bilder zeigt, dass die Spektrallinien mit steigendem Gasdruck breiter werden. Bei sehr großem Druck kann die Linienbreite so weit ansteigen, dass man ein Lichtkontinuum ähnlich wie bei einem Festkörper beobachtet. Ursache ist die häufiger werdende gegenseitige Störung der Atome beim Zusammenprall. Am Beispiel der Spektrallinie bei 491,6 nm erkennt man, dass die relative Intensität dieser Linie stark vom Gasdruck abhängt.
Im unteren Bild erkennt man die völlig andere Charakteristik der Spektrallinien des Elementes Cadmium.
Wird durch Absorption eines Photons ein Elektron ganz vom Atom gelöst, spricht man von einer Ionisierung des Atoms. Hierfür ist, abhängig vom Ausgangszustand des Elektrons, eine bestimmte Mindestenergie notwendig. Da für einen kontinuierlichen Energiebereich über der Mindestenergie eine Ionisierung möglich ist, spricht man von einem Kontinuum. Der umgekehrte Vorgang, die Emission eines Photons beim Einfangen eines Elektrons, nennt man Rekombination des Elektrons mit dem positiven Ion.
Molekülspektrum
Ein Molekülspektrum ist prinzipiell das Gleiche, wie ein Atomspektrum, allerdings liegen die relevanten Linien meistens im Infraroten.
Emissionsspektrum eines festen oder flüssigen Materials
Während das Emissionsspektrum verdünnter Gase also ein Linienspektrum ist, emittieren heiße Festkörper und Flüssigkeiten ein kontinuierliches Spektrum, weil die einzelnen Atome miteinander wechselwirken und keine diskreten Quantenzustände mehr haben. Dieses Spektrum lässt sich berechnen, indem man das Spektrum eines Schwarzen Strahlers (Plancksches Strahlungsgesetz) gleicher Temperatur mit dem Absorptionskoeffizienten für elektromagnetische Strahlung des Objekts bei der jeweiligen Wellenlänge multipliziert.
Wikimedia Foundation.
