- Accomplia
-
Strukturformel 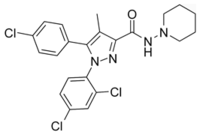
Allgemeines Freiname Rimonabant Andere Namen 5-(4-Chlorphenyl)-1- (2,4-dichlorphenyl)-4- methyl-N-(piperidin-1- yl)-1H-pyrazol-3-carboxamid
Summenformel C22H21Cl3N4O CAS-Nummer 168273-06-1 PubChem 104850 ATC-Code A08AX01
DrugBank DB06155 Arzneistoffangaben Wirkstoffklasse Wirkmechanismus Selektiver Cannabinoid-Rezeptor CB1 Antagonist
Fertigpräparate Acomplia® (D, CH) (Vom Markt genommen)
Verschreibungspflichtig: (ja) (Zulassung EU-weit entzogen) Eigenschaften Molare Masse 463,79 g·mol−1 Sicherheitshinweise Gefahrstoffkennzeichnung
unbekanntR- und S-Sätze R: ? S: ? Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Rimonabant ist ein Arzneistoff, der als Appetitzügler zur Behandlung des Übergewichts eingesetzt wurde, eigentlich allerdings zur Raucherentwöhnung von dem Pharmaunternehmen Sanofi-Aventis entwickelt wurde. Rimonabant greift in das körpereigene Cannabinoid-System (Endocannabinoidsystem) ein und vermittelt seine Wirkung über eine Hemmung von Cannabinoid-Rezeptoren des Subtyps CB1. Dieser Wirkstoff wurde zwischen 2006 und Oktober 2008 unter dem Markennamen Acomplia® angeboten. In den USA wurde die Substanz wegen ihrer psychiatrischen Schadwirkungen nicht zugelassen, in der EU führte eine intensive Diskussion der Risiken von Rimonabant im Oktober 2008 zu der Empfehlung der EMEA, die Zulassung ruhen zu lassen. (siehe Zulassung).
Inhaltsverzeichnis
Indikationen
Rimonabant war als Arzneistoff zusätzlich zu Diät und Bewegung zur Behandlung einer Adipositas (BMI >= 30 kg/m2) oder übergewichtiger Patienten (BMI > 27 kg/m2), die darüber hinaus einen oder mehrere Risikofaktoren wie Typ-2-Diabetes oder Dyslipidämie aufweisen, zugelassen.
Kontraindikationen
Rimonabant darf nicht bei Patienten mit Depression angewendet und nicht verordnet werden, wenn der Patient gleichzeitig ein Antidepressivum einnimmt. Bei Auftreten depressiver Symptome muss Acomplia sofort abgesetzt werden.[1]
Wirksamkeit, Klinische Studien
In den zulassungsrelevanten klinischen Studien verloren die mit Rimonabant behandelten Patienten etwas mehr Gewicht (4–5 %) als diejenigen Teilnehmer, die Scheinmedikament (Placebo) erhielten. Nach Absetzen des Medikaments steigt das Körpergewicht wieder an (Jo-Jo-Effekt).[2]
In den mit über 6.600 Patienten durchgeführten RIO-Studien wurde zusätzlich zur Gewichtsreduktion ein positiver Effekt auf die metabolischen Risikofaktoren gezeigt. Die Werte des umgangssprachlich „guten Cholesterins“ HDL stiegen, die Triglycerid-Werte und die Insulinresistenz bei Typ-2-Diabetikern sanken. In der nicht zulassungsrelevanten SERENADE-Studie senkte Rimonabant bei nicht-vorbehandelten Typ-2-Diabetikern den HbA1c-Wert und das Gewicht. Die Aussagekraft dieser Studien ist durch hohe Abbruchraten von 40–50 % stark eingeschränkt.
Nebenwirkungen
Die während der klinischen Studien am häufigsten beobachteten Nebenwirkungen waren Übelkeit, Durchfall, Schwindel und Atemwegsinfektionen. Herz-Kreislauf-Nebenwirkungen wurden nicht beobachtet.
Bei Einnahme der vorgeschriebenen Einnahmemenge (20 mg) können unerwünschte psychische Wirkungen auftreten: Depressionen (bei 2,9 % der Patienten, unter Placebo: 1,5 %), Angstgefühl (1,1 %, Placebo: 0,4 %) und Übelkeit (1,3 %, Placebo: <0,1 %). Patienten die zuvor wegen Depressionen behandelt worden sind, sollten diesen Wirkstoff nicht einnehmen. Eine gefährliche Nebenwirkung sind durch Rimonabant ausgelöste Suizidgedanken.[3] In Großbritannien sind fünf Patienten nach der Einnahme des Appetitzüglers Acomplia® gestorben.[4] Weitere mögliche unerwünschte Wirkungen sind Gedächtnisstörungen und vermutlich auch Krampfanfälle.
Zulassung
Ursprünglich wurde Rimonabant zur Raucherentwöhnung entwickelt. Eine entsprechende Zulassung wurde sowohl von der EU-Arzneimittelbehörde EMEA als auch von der amerikanischen Food and Drug Administration abgelehnt, da klinische Studien keinen ausreichenden Nachweis für die Wirksamkeit von Rimonabant zur Raucherentwöhnung erbrachten.[5]
Wegen des erhöhten Suizidrisikos ist Rimonabant in den USA derzeit nicht zugelassen. Ein FDA-Gutachtergremium[6] hat im Juni 2007 einstimmig die Zulassung abgelehnt, die endgültige Entscheidung war für den 27. Juli 2007 angekündigt.[7] Die Herstellerfirma ist jedoch der offiziellen Ablehnung durch Rücknahme des Zulassungsantrags zuvorgekommen.[8]
Das Gutachtergremium der Europäischen Arzneimittelagentur hat aufgrund der FDA-Entscheidung die Risiken von Rimonabant neu bewertet.[9] Im Ergebnis darf Acomplia an depressive Patienten nicht mehr verschrieben werden, auch die gleichzeitige Einnahme von Antidepressiva gilt jetzt als Kontraindikation.[10] Die EU-Zulassung von Acomplia erfolgte 2006 ohne eingehende Prüfung möglicher Risiken; diese sollten mittels eines Pharmakovigilanz-Programms ermittelt werden.[11]
Am 27. Juli 2007 hat das BfArM einen Rote-Hand-Brief über die vorgesehene Einschränkung der Anwendung von Rimonabant angekündigt.[12][13]
Eine erneute Diskussion des Nutzen-Risiko-Verhältnisses im Ausschuss für Humanarzneimittel der EMEA führte im Oktober 2008 zu der Empfehlung, die Zulassung ruhen zu lassen. Die Grundlage für die Neubewertung waren Daten aus neuen klinischen Studien und aus der Pharmakovigilanz, die im Vergleich zu den Zulassungsstudien einerseits ein deutlich höheres Risiko für ernste psychiatrische Störungen ergaben, andererseits in der Routineanwendung eine geringere Wirksamkeit als erwartet zeigten. Dadurch wurde das Nutzen-Risiko-Verhältnis ungünstig. Über die Empfehlung des CHMP müsse die Europäische Kommission noch eine bindende Entscheidung treffen; in der Zwischenzeit werde von weiteren Verschreibungen abgeraten.[14]
Daraufhin hat Sanofi-Aventis auf Druck der EMEA das Schlankheits-Medikament vom Markt genommen. [15]
Einzelnachweise
- ↑ EMEA/CHMP: Questions and Answers on the Safety of ACOMPLIA (RIMONABANT), 19 Juli 2007.
- ↑ arznei-telegramm 2006;37:77-78.
- ↑ Dt. Ärzteblatt online: Abmagerungsmittel Rimonabant kann Suizidgedanken auslösen, 12. Juni 2007.
- ↑ Dt. Ärzteblatt online: Todesfälle nach Einnahme von Rimonabant, 4. Juni 2008.
- ↑ Europäischer öffentlicher Beurteilungsbericht (EPAR) - ACOMPLIA
- ↑ Unterlagen des FDA-Begutachtungsverfahrens
- ↑ FDA: Keine Zulassung für Rimonabant in den USA; Dt. Ärzteblatt online, 14. Juni 2007.
- ↑ arznei-telegramm 2007;38:72.
- ↑ Acomplia®: EMEA will auf Nichtzulassung in den USA reagieren; Dt. Ärzteblatt online, 15. Juni 2007.
- ↑ Abmagerungsmittel: Kontraindikationen, aber kein Verbot von Acomplia®; Dt. Ärzteblatt online, 20. Juli 2007.
- ↑ EPAR, Scientific Discussion; p.36-37.
- ↑ BfArM: Acomplia (Rimonabant): Europäische Arzneimittelagentur empfiehlt Anwendungsbeschränkungen
- ↑ Rote Hand Brief: Erhöhte Häufigkeit von Berichten über Depressionen bei Patienten, die mit ACOMPLIA® behandelt werden. 27. Juli 2007.
- ↑ Pressemitteilung der EMEA zur Empfehlung, die Zulassung ruhen zu lassen (PDF)
- ↑ http://www.handelsblatt.com/unternehmen/industrie/aus-fuer-schlankheits-mittel-von-sanofi-aventis;2071017
Weiterführende Literatur
RIO-Studien:
- Lipids: New England Journal of Medicine 2005;353:2121-2134; PMID 16291982.
- Europe: The Lancet 2005;365:1389-1397; PMID 15836887.
- North-America: JAMA 2006;295:761-775; PMID 16478899.
- Diabetes: The Lancet 2006;368:1660-1672; PMID 17098084.
Bewertung
- Cochrane-Review: Rimonabant for overweight or obesity. Cochrane Database Syst Rev. 2006 Oct 18;(4):CD006162; PMID 17054276.
- Drug treatments for obesity: orlistat, sibutramine, and rimonabant. The Lancet 2007;369:71-77; PMID 17208644.
Weblinks
- RIO-Studie
- Unerwünschte Wirkungen - Depressionen - Angstgefühl - Nausea
- Mens Health - Meinung von US-Pharmakologe Piomelli
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.
