- Daltons Atomhypothese
-
Ein Atommodell ist ein Modell, das auf der Grundlage beobachtbarer Eigenschaften der Materie und experimentell ermittelter Daten den Aufbau der Atome beschreibt.
Die Modelle der Atomphysik konnten im Laufe der Zeit immer mehr Beobachtungen erklären, wurden aber auch komplizierter. Heute ist man in der Lage, Atome mit Hilfe der Quantenmechanik zu beschreiben.
Auf die Frage, wie man sich denn ein Atom nun vorzustellen habe, antwortete der Physiker Werner Heisenberg: „Versuchen Sie es gar nicht erst!“ Diese Aussage ist heute aktueller denn je, da neuere Atommodelle nur noch mit mathematischen Formeln darzustellen sind.
Inhaltsverzeichnis
Voraussetzungen
Voraussetzung für die Entwicklung von Atommodellen war die Entdeckung der Atome und die Entdeckung, dass auch diese aus kleineren Teilchen aufgebaut sind. Leukipp und dessen Schüler Demokrit postulierten um etwa 500 v. Chr., dass alle Stoffe aus definierten kleinsten Teilchen, den Atomen (gr. Atomos, das Unteilbare) bestünden. Daniel Sennert formulierte 1618 sein Gesetz der Erhaltung der Elemente: Bei einer chemischen Reaktion gingen Elemente weder verloren, noch würden Elemente neu geschaffen. Robert Boyle entdeckte 1661, dass Elemente bestimmte primitive und einfache, völlig unvermischte Körper seien, sie enthielten keine anderen Körper und seien Zutaten, aus denen alle perfekt gemischten Körper zusammengesetzt seien und in welche diese letztlich zerlegt werden könnten. Antoine Laurent de Lavoisier formulierte 1785 das Gesetz der Erhaltung der Masse. Er stellte fest, dass die Summe der Massen der Edukte stets gleich der Summe der Massen der Produkte ist. Jeremias Benjamin Richter bemerkte schließlich 1791/92 das Gesetz der äquivalenten Proportionen.
Erste experimentelle Hinweise auf Atome gibt es erst Ende des 18. Jahrhunderts, als John Dalton sein Gesetz der multiplen Proportionen findet. Aufgrund seiner Atomhypothese sagt er das Gesetz der konstanten Proportionen voraus, welches von Joseph-Louis Proust 1799 formuliert wird.
- Siehe auch: Atomphysik
Daltons Atomhypothese (1803)
- Materie besteht aus kleinsten kugelförmigen Teilchen oder Atomen.
- Diese Atome sind unteilbar und können weder geschaffen noch zerstört werden.
- Alle Atome eines chemischen Elements sind untereinander gleich. Atome unterscheiden sich nur in der Masse von Atomen anderer Elemente.
- Diese Atome können chemische Bindungen eingehen und aus diesen auch wieder gelöst werden.
- Das Teilchen einer Verbindung wird aus einer bestimmten, stets gleichen Anzahl von Atomen der Elemente gebildet, aus denen die Verbindung besteht.
Gegenargumente für Daltons Theorie waren jedoch z. B. das elektrische Aufladen von Atomen, welches die Teilbarkeit der Atome voraussetzt.
Meist wurden Atome als feste Kugeln angenommen. Dies änderte sich erst, als Joseph John Thomson 1897 das Elektron entdeckte, dieses wurde 1874 erstmals von George Johnstone Stoney vorausgesagt und 1891 namentlich benannt.
Atommodelle
Kugelteilchenmodell (etwa 400 v. Chr.)
Demokrit erklärte sein Atom, als ein kleines unteilbares Teilchen, das fest und kugelförmig sei. Seine Behauptung basierte auf folgender Überlegung: „Es kann nicht sein, ließe sich ein Brett unendlich mal teilen, so bestünde das Brett schließlich aus nichts!“. So stellte er die These auf, dass es ein Unteilbares geben muss. Er dachte auch, dass Atome verschiedene Formen haben könnten, wie beispielsweise krumm, glatt und unregelmäßig. Glatte Gegenstände sollen aus runden und rauhe aus eckigen Atomen bestehen. So erklärte er auch unsere Materie, dass Pflanzen, Feuer und Menschen aus diesen kleinen Teilchen bestehen, die zusammenfallen und zum Beispiel Wasser bilden. Außerdem nahm er an, dass unsere Seele aus Seelenatomen besteht, welche auseinander fallen und zu einer neuen Seele fliegen, wenn ein Mensch stirbt.
Demokrits Gedankenmodell, mit dem er die Existenz seiner Atome begründet, enthält einen Fehler, der darauf beruht, das im antiken Griechenland der mathematische Begriff des Grenzwertes einer Folge noch nicht bekannt war. So ist es eben nicht so, dass die Länges eines Stabes oder ähnlichem gleich null würde, würde man den Stab unendlich oft teilen und die Summe der Teillängen addieren. Der Grenzwert einer solchen Folge wäre immer noch gleich der Länge des unzerteilten Stabes.
Dynamidenmodell (1903)
Nach dem Dynamidenmodell (nach Philipp Lenard) bestehen Atome zum größten Teil aus leerem Raum zwischen kleinen, rotierenden elektrischen Dipolen, den Dynamiden. Die atomare Massenzahl ist gleich der Zahl der Dynamiden in dem Atom. Das Modell blieb weitgehend unbekannt.
Thomsonsches Atommodell (1903)
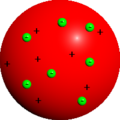
Nach dem Thomsonschen Atommodell besteht das Atom aus einer gleichmäßig verteilten positiven Ladung und negativ geladenen Elektronen, die sich darin bewegen. Dieses Modell wird auch als Plumpudding-Modell oder zu deutsch Rosinenkuchenmodell bezeichnet.
Planetarisches Modell / Saturnmodell (1904)
In diesem Modell, welches vom japanischen Physiker Nagaoka Hantarō entwickelt wurde, ist das Atom eine große, positiv geladene Kugel, die von den negativ geladenen Elektronen umkreist wird. In Analogie zur Stabilität der Ringe des Saturns sagte das Modell einen massereichen Kern voraus, um den sich die durch die Coulombkraft gebundenen Elektronen bewegen. Andere Vorhersagen des Modells dagegen waren unzutreffend, Hantaro selbst hielt nach 1908 nicht mehr daran fest.
Rutherfordsches Atommodell (1911)
Nach dem Rutherfordschen Atommodell (nach Ernest Rutherford) besteht das Atom aus einem positiv geladenen Atomkern, der nahezu die gesamte Masse des Atoms beinhaltet und einer Atomhülle, in der die Elektronen um den Kern kreisen. Dieses Modell wurde entworfen, weil geladene Teilchen Atome weitgehend störungsfrei passieren können.
Bohrsches Atommodell (1913)
Nach dem Bohrschen Atommodell (nach Niels Bohr) besteht das Atom aus einem positiv geladenen, massetragenden Kern und Elektronen, die diesen auf diskreten Bahnen umkreisen.
Bohr-Sommerfeldsches Atommodell (1916)
Das Bohr-Sommerfeldsche Atommodell ist eine Erweiterung des bohrschen Atommodells durch Arnold Sommerfeld. In ihm sind auch bestimmte Ellipsenbahnen um den Atomkern zugelassen.
Orbitalmodell (1928)
Nach dem Orbitalmodell besteht das Atom aus einem Kern, der von Orbitalen umgeben ist. Die Form der Orbitale ist durch die räumliche Aufenthaltswahrscheinlichkeit der Elektronen gegeben. Im strengen Sinn ist ein Orbital eine Lösung der Schrödingergleichung.
Didaktische Modelle
Die didaktischen Modelle dienen der Veranschaulichung und sind keine Modelle im wissenschaftlichen Sinn.
Schalenmodell
Im Schalenmodell wird ein positiv geladener Atomkern von Kugelschalen umgeben, in denen sich die Elektronen befinden. Nur die jeweils äußerste Schale ist für die chemischen Eigenschaften des Elements verantwortlich. Über die Bewegung der Elektronen wird keine Aussage gemacht. Das Schalenmodell ist
- eine Erweiterung des Bohrschen Atommodells: Elektronen kreisen um den Atomkern wie die Planeten um die Sonne und
- eine Vereinfachung des Orbitalmodells: der Aufenthaltsort der Elektronen kann nur durch eine Wahrscheinlichkeitsfunktion – die sogenannte Wellenfunktion als Lösung der Schrödingergleichung – bestimmt werden. Die Wellenfunktion kann durch sogenannte Wahrscheinlichkeitswolken oder -schalen visualisiert werden.
Kugelwolkenmodell
Das Kugelwolkenmodell (Kimballsches Atommodell, Tetraedermodell) ist ein in der Schule häufig verwendetes Atommodell, mit dem sich viele Phänomene (Atombindung, Molekülbau) erklären lassen. Es stellt eine Erweiterung des Schalenmodells dar und ist eine Vereinfachung gegenüber dem genaueren Orbitalmodell.
Punktteilchen und inkompressible Kugeln
In einigen Fällen können Atome als Punkte ohne Ausdehnung genähert werden (z. B. ideales Gas), in anderen als Kugeln mit bestimmtem Volumen (z. B. Van-der-Waals-Gas).
Kern und Hülle
Der Radius des Atomkerns ist etwa um den Faktor 10.000 kleiner als der Radius der Atomhülle.
Wenn man also vom Radius eines Atoms spricht, dann ist immer der Außen-Radius der Atomhülle gemeint (im anderen Falle spricht man vom Kernradius). Der Atomradius schwankt zwischen 0,3·10−10 m und 2,62·10−10 m.
Der Atomkern wird aus Protonen und Neutronen (allgemein werden diese Elementarteilchen als Nukleonen bezeichnet) gebildet. Er enthält fast die gesamte Masse des Atoms (mehr als 99,9%) und ist positiv geladen. Die Anzahl der Protonen bestimmt die Zugehörigkeit zu einem bestimmten Element. Sein Radius beträgt ungefähr 10−14 m.
Bei Atomen mit der gleichen Anzahl Protonen, aber unterschiedlich vielen Neutronen im Kern spricht man von Isotopen des jeweiligen Elements.
Die Atomhülle wird von den Elektronen gebildet. Sie kompensiert durch ihre negative Ladung die Ladung des positiven Atomkerns, sodass das Atom nach außen zumeist neutral ist. Die Neutralität gilt in großer Entfernung bezogen auf die Ausdehnung des Atoms oder im zeitlichen Mittel über ausreichend lange Zeiträume bezogen auf die zeitlichen Änderungen in der Ladungsverteilung der Elektronen in der Hülle.
Enthält die Hülle mehr oder weniger Elektronen als der Kern Protonen, so spricht man von einem Ion und die elektrische Neutralität ist auch in großer Entfernung oder im zeitlichen Mittel nicht mehr gegeben. Das Ion ist effektiv geladen.
Modelle des Atomkerns
Es gibt auch Modelle, die sich ausschließlich mit dem Atomkern beschäftigen.
Tröpfchenmodell (1936)
Das Tröpfchenmodell beschreibt den Atomkern als Tröpfchen einer geladenen Flüssigkeit. Mit diesem klassischen Modell kann etwa die Kernspaltung gut erklärt werden.
Schalenmodell (1949)
Das Schalenmodell des Atomkerns wurde synchron von Eugene Paul Wigner, Maria Goeppert-Mayer und J. Hans D. Jensen im Jahre 1949 postuliert. Es führt den Aufbau der Atomkerne auf quantenmechanische Gesetzmäßigkeiten (Pauli-Prinzip) zurück. Im Gegensatz zu dem Tröpfchenmodell ist das Schalenmodell ein Modell, das Nukleonen eine relative Bewegungsunabhängigkeit zugesteht.
Weblinks
- Übersicht über die Atommodelle Planetenmodell, Schalenmodell, Wellenmechanisches Modell, Schrödingergleichung und Ansichten der Orbitale
- Geschichte der Atomphysik
- Geschichte der kleinsten „unteilbaren“ Teilchen Erstaunlich gute Einführung des Leistungskurses der 12. Klasse des Georg-Forster-Gymnasiums.
- Sehr einfache Übersicht der Entwicklung des Atommodells auf Englisch
- Animierte Darstellung aller Atome nach dem Bohrmodell
- Atomic Physics – eine englische Einleitung
- Bohrsches Atommodell – eine Einführung für die Schule (Universität Ulm)
Wikimedia Foundation.


.png)

