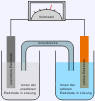
- Daniellsches Element
-
Das Daniell-Element (auch Daniell'sches Element) ist eine galvanische Zelle, die aus einer Zink- und einer Kupfer-Halbzelle besteht. Sie ist nach John Frederic Daniell, der sie 1836 entdeckte, benannt. In den folgenden Jahren war das Daniell-Element eine der wichtigsten Stromquellen für elektrische Telegrafen. Aufgrund ihres einfachen Aufbaus dient sie heute in der Lehre oft als Modell für galvanische Zellen.
Inhaltsverzeichnis
Typischer (modellhafter) Aufbau
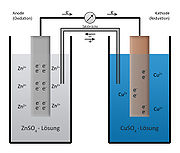 Daniell-Element; links die Donatorhalbzelle mit unedlerem Zink; rechts die Akzeptorhalbzelle mit dem edleren Kupfer
Daniell-Element; links die Donatorhalbzelle mit unedlerem Zink; rechts die Akzeptorhalbzelle mit dem edleren KupferEin Zinkstab und ein Kupferstab werden in ihre entsprechenden Ionenlösungen (z. B. Zinksulfat-Lösung und Kupfersulfat-Lösung) gestellt und leitend miteinander verbunden. (Alternativ können auch ein Tonzylinder, oder ein spezielles U-Rohr mit Diaphragma verwendet werden).
Es liegen 2 Redoxpaare (Zn/Zn2+ sowie Cu/Cu2+) vor.
Die Reaktion kommt dann zustande, wenn beide Teilsysteme elektrisch (Draht zwischen den Elektroden, dem Elektronenleiter) und elektrolytisch (Salzbrücke, auch Stromschlüssel oder Ionenleiter genannt, oder Diaphragma (z.B. durchlässige Tonwand) zwischen den Lösungen) verbunden sind. Die Salzbrücke bzw. das Diaphragma dient dazu, die Diffusions-Durchmischung der Lösungen zu verhindern und dennoch einen Ladungsausgleich zu ermöglichen.
Eine Salzbrücke besteht aus einem Rohr, das mit einer Salzlösung - Kaliumchlorid ist z.B. aufgrund seiner guten Löslichkeit gut geeignet - gefüllt ist. Die Enden des Rohres werden mit Watte verschlossen, sodass Ionen zum Ladungsausgleich hindurchdiffundieren können, jedoch keine Strömung stattfinden kann.
Funktionsweise
Zink hat ein geringeres Standardpotential als Kupfer, d.h. Zink ist unedler als Kupfer und die Lösungstension von Zink ist größer. Deshalb gehen am Zinkstab verhältnismäßig viele Zinkionen in Lösung, während sich am Kupferstab nur relativ wenige Kupferionen ablösen und ihre Elektronen im Metall zurücklassen. In der Zinkelektrode (hier: Anode) werden also (wie im Schaubild sichtbar) mehr Elektronen zurückgelassen, weswegen sie negativer geladen ist als der Kupferstab, was den Aufbau einer Spannung bedeutet.
Die überschüssigen Elektronen im oxidierenden Zink wandern über einen Leiter vom Zink zum Kupfer. Dabei lässt sich (bei Standardbedingungen) eine Spannung von 1,10 Volt messen. Diese ist die Elektromotorische Kraft, die sich aus dem Redoxpotenzial von Kupfer (E0(Cu) = + 0,34 V) und dem von Zink (E0(Zn) = -0,76 V) zusammensetzt (siehe Weblink).
Die gelösten Kupferionen nehmen die Elektronen auf und lagern sich als Kupfer an der Elektrode (hier: Kathode) ab.
Da auf der einen Seite positive Zinkionen in Lösung gehen und sich auf der anderen Seite Kupfer ablagert, muss ein Ladungsausgleich stattfinden; dies geschieht über die Salzbrücke. So wird der Stromkreis geschlossen.
Die beiden Teilvorgänge der Redoxreaktion können also räumlich getrennt werden. Die Elektronen gehen nicht direkt vom System Zn/Zn2+ auf das System Cu/Cu2+ über, sondern wandern zuerst über einen Draht vom Zn zum Cu. Es fließt ein Elektronenstrom.
Die beiden getrennten Teilsysteme nennt man „Halbzellen“.
Die Zinkelektrode löst sich also mit der Zeit auf (siehe Korrosion), während die Kupferelektrode schwerer wird.
Das Daniell-Element liefert, wie oben beschrieben, eine Spannung von 1,10 Volt.
Beim Daniell-Element stellt - wie bei allen galvanischen Zellen - die Anode den Minuspol und die Kathode den Pluspol dar.
Es gilt folgende Zuordnung
Anode: Elektrode, an der Teilchen oxidiert werden.
Kathode: Elektrode, an der Teilchen reduziert werden.
Eselsbrücke: An-o-de: An Oxidation denken.
Oder: O-M-A (Oxidation, Minuspol, Anode)
Oder: Anode und Oxidation - das A und O der Elektrochemie
Oder: A O K (R) - Anode-Oxidation;Kathode-Reduktion
Oder: Alpha & Omega - Katholische Religion
Oder: Vokale: A|O und Konsonanten: K|R
Reaktionsgleichung
Zellendiagramm: Zn/Zn2+//Cu2+/Cu
Oxidation:
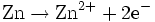
Reduktion:
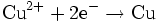
Gesamtreaktion (Redoxreaktion):
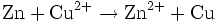
Primärzellen: Alkali-Mangan-Batterie | Daniell-Element | Leclanché-Element | Lithium-Batterie | Lithium-Eisensulfid-Batterie | Nickel-Oxyhydroxid-Batterie | Quecksilberoxid-Zink-Batterie | Silberoxid-Zink-Batterie | Zink-Braunstein-Zelle | Zinkchlorid-Batterie | Zink-Luft-Batterie
Sekundärzellen: Bleiakkumulator | Natrium-Schwefel-Akkumulator | Nickel-Cadmium-Akkumulator | Nickel-Eisen-Akkumulator | Nickel-Metallhydrid-Akkumulator | Nickel-Wasserstoff-Akkumulator | Lithium-Eisen-Phosphat-Akkumulator | Lithium-Ionen-Akkumulator | Lithium-Mangan-Akkumulator | Lithium-Polymer-Akkumulator | Lithium-Titanat-Akkumulator | Vanadium-Redox-Akkumulator
Ausführungen: Akkumulator | Batterie | Brennstoffzelle | Konzentrationselement | Redox-Flow-Zelle | Bestandteile: Halbzelle (Donator- und Akzeptorhalbzelle)
Wikimedia Foundation.