- Adenylatkinase
-
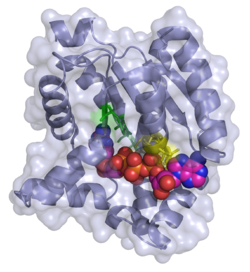
Adenylat-Kinase Bänder-/Oberflächenmodell mit Bis-adenosin-tetraphosphat (ADP-ADP) nach PDB 2C95. Aktives Zentrum grüne, ADP-Bindungsstelle gelbe Stäbchen Vorhandene Strukturdaten: 1z83, 2c95 Größe 194 Aminosäuren Struktur Monomer Bezeichner Gen-Name AK1 Externe IDs OMIM: 103000 UniProt: P00568 Enzymklassifikation EC, Kategorie 2.7.4.3 Kinase Reaktionsart (De-)Phosphorylierung Substrat ATP + AMP Produkte ADP + ADP Das Enzym Adenylat-Kinase (AK1) (auch Myokinase) katalysiert folgende Reaktionen, um die Balance zwischen dem Phosphatakzeptor ADP und dem Phosphatdonator ATP aufrecht zu halten:
- 2 ADP -> ATP + AMP
In weiterer Folge wird durch die Hydrolyse des ATPs Energie frei, welche im Muskel oder anderen Geweben genutzt werden kann.
Die Reaktion ist auch in die andere Richtung möglich, falls ATP im Überschuss vorhanden ist und ADP als Energiespeicher notwendig ist:
- ATP + AMP -> 2 ADP
In Säugetieren haben sich mindestens drei Isoformen des Enzyms entwickelt, im Mensch sind fünf Allele bekannt. Die älteste Form ist auch in anderen Lebewesen, mit Ausnahme der Archaeen, zu finden. Im Mensch ist sie in allen Gewebetypen lokalisiert. Ein durch Mutation am AK1-Gen hervorgerufener Adenylat-Kinase-Mangel führt zu einer Form der hämolytischen Anämie.[1][2]
Einzelnachweise
Weblinks
Wikimedia Foundation.