- (NH4)2Cr2O7
-
Strukturformel 
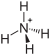
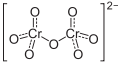
![\mathrm{ \ \!\ \Biggr]_2}](/pictures/dewiki/48/07a3843eb4b51c9bed598e32e34f28db.png)
Allgemeines Name Ammoniumdichromat Andere Namen - Ammoniumbichromat
- Doppeltchromsaures Ammonium
Summenformel (NH4)2Cr2O7 CAS-Nummer 7789-09-5 Kurzbeschreibung leuchtend orangerote Kristalle Eigenschaften Molare Masse 252,07g/mol Aggregatzustand fest
Dichte 2,15 g/cm3[1]
Schmelzpunkt 180 °C (Explosionsartige Zersetzung)[1]
Löslichkeit gut (360 g/l) in Wasser[1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 


Explosions-
gefährlichSehr giftig Umwelt-
gefährlich(E) (T+) (N) R- und S-Sätze R: 45-46-60-61-2-8-21-25-26-34-42/43-48/23-50/53 S: 53-45-60-61 LD50 53,75 mg/kg[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Ammoniumdichromat ist ein Ammoniumsalz der Dichromsäure. Es besitzt die Formel (NH4)2Cr2O7.
Inhaltsverzeichnis
Eigenschaften
Ammoniumdichromat ist ein orangefarbenes Pulver, das gut in Wasser löslich ist. Auf Grund seiner Zusammensetzung aus einem leicht oxidierbarem Kation (Ammoniumion) und einem starken Oxidationsmittel (Dichromat), ist es explosiv und instabil. Allein bei starker Reibung zerfällt es unter heftiger Explosion.
Das bekannteste Experiment zur Zersetzung von kristallinem Ammoniumdichromat ist der Vulkanversuch. Dabei wird ein größerer Kristall oder ein kleines Häufchen oben entzündet. Nach dem Entzünden schreitet die Reaktion unter lebhaftem Glühen, Rauschen (Stickstoffentwicklung) und der Bildung von lockerem graugrünen Dichromtrioxid fort. Das gebildete Dichromtrioxid quillt wie Vulkanasche aus der Reaktionsstelle hervor und bildet so einen Kegel. Die entsprechende Reaktionsgleichung für diese Reaktion lautet:
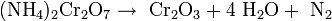
Insgesamt ist Ammoniumdichromat ein starkes Oxidationsmittel, das mit starken Reduktionsmitteln wie zum Beispiel fein verteilten Metallpulvern, Schwefel, oder Phosphor sehr heftig (explosiv) reagiert (R8).
Wegen seiner ionischen Natur und den in Wasser ausgebildeten Dissoziationsgleichgewichten wirkt das Ammoniumdichromat ätzend (R34).
Toxikologie und Ökotoxikologie
Ammoniumdichromat ist toxikologisch von der EU-Kommission eingestuft als:
Krebserzeugend Kategorie: 2 (R45: Kann Krebs erzeugen.)[3]
Mutagen Kategorie: 2 (R46: Kann vererbbare Schäden verursachen.)[3]
Reproduktionstoxisch Kategorie: 2 (R60-61: Kann die Fortpflanzungsfähigkeit beeinträchtigen und kann das Kind im Mutterleib schädigen.)
Weiterhin ist es als sehr giftig beim Einatmen (R26) und giftig beim Verschlucken (R25) eingestuft. Der Kontakt mit der Haut wird als gesundheitsschädigend (R21) bewertet. Eine weitere Gefahr von Ammoniumdichromat stellt die Möglichkeit einer Sensibilisierung (Allergie) durch Einatmen und Hautkontakt (R42/43) dar.
Ökotoxikologisch gilt es als sehr giftig für Wasserorganismen und kann eine längerfristige schädigende Wirkung auf Gewässer haben (R50/53). In der Verwaltungsvorschrift wassergefährdender Stoffe (VwVwS Stand Juli 2005) ist Ammoniumdichromat mit der Kenn-Nummer 290 in die höchste Wassergefährdungsklasse 3 eingestuft. Auf Grund des in der Literatur angegebenen Biokonzentrationsfaktors von 200 - 2000 ist eine Anreicherung in Organismen möglich.
Verwendung
- In der Fotografie und den Edeldruckverfahren (besonders im Lichtdruck und Gummidruck):
Ammoniumdichromat gerbt unter Lichteinwirkung Gelatine oder andere Kolloide, wodurch diese selbst zur Farbschicht oder aber zum Farbträger werden.
- In pyrotechnischen Erzeugnissen.
- Zur Herstellung von Holzschutzmitteln für industrielle Anwendung.
- Zur Herstellung von Chrom(IV)-oxid für magnetische Datenträger.
- Zur Herstellung von Katalysatoren für organische Synthesen.
Besondere gesetzliche Regulierungen
Ammoniumdichromat unterliegt der Chemikalienverbotsverordnung und dem Sprengstoffgesetz. In industriellen Mengen unterliegt es außerdem der Störfallverordnung und dem Wasserhaushaltsgesetz.
Weiterhin bestehen Beschäftigungsbeschränkungen für Jugendliche (Jugendarbeitsschutzgesetz), sowie für werdende und stillende Mütter (Mutterschutzrichtlinie).
Quellen
- ↑ a b c d Sicherheitsdatenblatt (Merck)
- ↑ Eintrag zu CAS-Nr. 7789-09-5 im European chemical Substances Information System ESIS
- ↑ a b Diese Bewertung bleibt auch bei Verdünnung bis zu 0,1 % bestehen!
Wikimedia Foundation.

