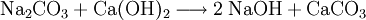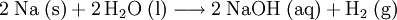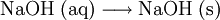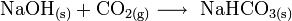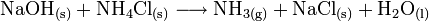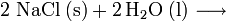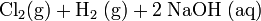- E524
-
Kristallstruktur 
__ Na+ __ OH− Allgemeines Name Natriumhydroxid Andere Namen - Ätznatron
- Ätzsoda
- kaustische(s) Soda
- Natriumoxydhydrat
- Natronhydrat
- Natronlauge (wässrige Lösung)
- Seifenstein
- E 524
Verhältnisformel NaOH CAS-Nummer 1310-73-2 Kurzbeschreibung weißer, kristalliner Feststoff, oft in Form von Pellets Eigenschaften Molare Masse 39,997 g·mol−1 Aggregatzustand fest
Dichte 2,130 g·cm−3 [1]
Schmelzpunkt 322 °C [1]
Siedepunkt 1388 °C [1]
Dampfdruck Löslichkeit Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 
Ätzend (C) R- und S-Sätze R: 35 S: (1/2)-26-37/39-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Natriumhydroxid (auch Ätznatron, kaustische(s) Soda), chemische Formel NaOH, ist ein weißer hygroskopischer Feststoff. In Wasser löst es sich unter großer Wärmeentwicklung durch die negative Lösungsenthalpie von -44,5 kJ/mol zur stark alkalisch reagierenden Natronlauge auf (pH 14 bei c = 1 mol/l). Mit dem Kohlenstoffdioxid der Luft reagiert es zu Natriumhydrogencarbonat und wird deshalb in luftdicht verschlossenen Behältern aufbewahrt. Um zu verhindern, dass das Natriumhydroxid Wasser aus der Luft bindet, kann man es gemeinsam mit einem Trockenmittel lagern. Das Hydroxid-Ion verdrängt als starke Base schwächere und flüchtige Basen aus ihren Salzen.
Inhaltsverzeichnis
Herstellung
Im Labor kann Natriumhydroxid durch Umsetzung von Natriumcarbonat mit Calciumhydroxid zu Natriumhydroxid und Calciumcarbonat hergestellt werden:
Das wenig lösliche Calciumcarbonat wird abfiltriert. Im Filtrat verbleibt das gut lösliche Natriumhydroxid. Dieser Prozess der Kaustifizierung wurde früher großtechnisch durchgeführt.
Eine weitere Methode ist die exotherme Reaktion von elementarem Natrium mit Wasser unter Bildung von Natronlauge und Wasserstoff:
In der Schule wird dieser Versuch häufig gezeigt, um die Reaktivität der Alkalimetalle mit Wasser zu demonstrieren.
Nach dem Eindampfen der Natronlauge bleibt festes Natriumhydroxid zurück:
Weitere Reaktionen
Lässt man NaOH offen an der Luft liegen, reagiert dieses mit dem Kohlenstoffdioxid der Luft zu Natriumhydrogencarbonat, daher wird es in luftdicht verschlossenen Behältern aufbewahrt.
Im Labor lässt sich Ammoniak einfach durch die Säure-Base-Reaktion aus Natriumhydroxid und Ammoniumchlorid herstellen.
Elektrolyse
- siehe Hauptartikel: Chlor-Alkali-Elektrolyse
Industriell wird Natriumhydroxid durch Elektrolyse von Natriumchlorid zu Natronlauge, Wasserstoff und Chlorgas hergestellt:
Es gibt dafür drei verschiedene Verfahrenstechniken:
Allen Verfahren gemein sind zusätzliche Reinigungs- und Aufkonzentrierungsstufen, um zu wasserfreiem Natriumhydroxid zu gelangen.
Verwendung
Natriumhydroxid wird hauptsächlich in Form von Natronlauge verwendet. Zu deren Verwendung siehe dort. Festes Natriumhydroxid ist ein wesentlicher Bestandteil von Abflussreinigern.
Versuchsbeispiel
Gibt man ein wenig Natriumhydroxid in Wasser und verrührt es, erwärmt sich die Lösung. Das eignet sich als einfaches Beispiel für einen exothermen Lösungsvorgang, das beispielsweise in der Schule angewandt wird. Den gegenteiligen Effekt, einen endothermen Lösungsvorgang, kann man beobachten, wenn man Kaliumnitrat oder Ammoniumnitrat in Wasser löst, wobei der Effekt beim Lösen von Ammoniumnitrat wesentlich stärker ist (Temperaturabnahme von ca. 10 K).
Quellen
- ↑ a b c d e Eintrag zu CAS-Nr. 1310-73-2 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 15. Februar 2007 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 1310-73-2 im European chemical Substances Information System ESIS
Weblinks
Wikimedia Foundation.