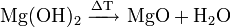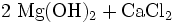- E 528
-
Kristallstruktur 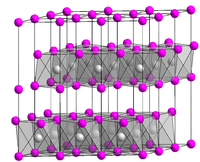
__ Mg2+ __ OH- Allgemeines Name Magnesiumhydroxid Andere Namen - Magnesium(II)-hydroxid
- Brucit
- E528
Verhältnisformel Mg(OH)2 CAS-Nummer 1309-42-8 ATC-Code Kurzbeschreibung weißes Pulver Eigenschaften Molare Masse 58,33 g·mol–1 Aggregatzustand fest
Dichte 2,38 g·cm–3 [1]
Schmelzpunkt 350 °C (Zersetzung) [1]
Löslichkeit schlecht in Wasser (0,009 g·l−1 bei 18 °C)[1] und Alkohol, gut in Ammoniumsalzlösungen und verdünnten Säuren
Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Magnesiumhydroxid Mg(OH)2 kommt in der Natur als Mineral Brucit vor. Das Kristallgitter von Brucit besteht aus einer hexagonal-dichtesten Kugelpackung von Hydroxidionen. Jede zweite Oktaeder-Lückenschicht ist mit Magnesiumionen (Mg2+) besetzt.
Inhaltsverzeichnis
Eigenschaften
In Wasser und alkalischen Lösungen ist Magnesiumhydroxid schwer löslich, dagegen in sauren Lösungen (beispielsweise Salzsäure, Salpetersäure) gut löslich. Auch in Ammoniumsalzlösungen ist Magnesiumhydroxid gut löslich, da die Hydroxidionen durch die Ammoniumionen abgefangen werden:
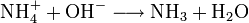 .
.
Magnesiumhydroxid bildet mit Säuren basische und neutrale Salze.
Bei Temperaturen oberhalb von 350 °C tritt langsam Zersetzung zum Magnesiumoxid ein. Bei 600 °C liegt das Gleichgewicht praktisch auf der Seite des Oxides.
Gewinnung und Darstellung
Magnesiumhydroxid kann aus Restlaugen der Kaligewinnung durch Ausfällen mit Kalkmilch (1) oder aus Meerwasser durch Ausfällen mit gebranntem Dolomit (2) gewonnen werden. Das Produkt wird anschließend filtriert und bei etwa 100 °C getrocknet. Besonders reines Magnesiumhydroxid entsteht durch Einwirken von Wasser auf elementares Magnesium (3).
(1)
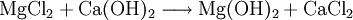
(2)
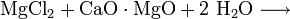
(3)

Verwendung
Der größte Teil des für industrielle Zwecke hergestellten Magnesiumhydroxids wird durch Kalzinieren (Brennen) bei 500–600 °C zu Magnesiumoxid weiterverarbeitet.
Magnesiumhydroxid wird als Speiseölzusatz (zum Abbinden von Schwefeldioxid), als Flockungsmittel für die Abwasseraufbereitung, als Flammschutzmittel in thermoplastischen Kunststoffen (Polyolefinen, PVC) und Elastomeren sowie als Zusatzstoff in Reinigungsmitteln verwendet.
In der Medizin kommt es als Antazidum (Arznei zur Neutralisierung der Magensäure) und als sehr starkes Abführmittel zum Einsatz.
Magnesiumhydroxid wird Lebensmitteln als Säureregulator oder Trennmittel zugesetzt. Es ist in der EU als Lebensmittelzusatzstoff mit der E-Nummer E 528 zugelassen.
Quellen
Wikimedia Foundation.