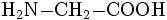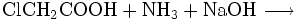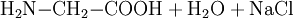- E 640
-
Strukturformel 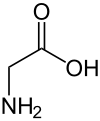
Allgemeines Name Glycin Andere Namen - Gly (Dreibuchstabencode)
- G (Einbuchstabencode)
- Glykokoll
- Glykoll
- Aminoessigsäure
- Aminoethansäure
Summenformel C2H5NO2 CAS-Nummer 56-40-6 PubChem 750 ATC-Code B05CX03
DrugBank NUTR00028 Kurzbeschreibung farbloser, kristalliner Feststoff [1] Eigenschaften Molare Masse 75,07 g·mol−1 Aggregatzustand fest
Dichte 1,60 g·cm−3 [1]
Schmelzpunkt pKs-Wert - pKCOOH: 2,35
- pKNH2: 9,78 (je bei 25 °C)[2]
Löslichkeit - gut löslich in Wasser (249,9 g·kg−1 bei 25 °C; 391,0 g·kg−1 bei 50 °C; 543,9 g·kg−1 bei 75 °C; 671,7 g·kg−1 bei 100 °C) [3]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Glycin (chemisch Aminoessigsäure genannt), ist die kleinste und einfachste proteinogene α-Aminosäure. Es gehört zur Gruppe der hydrophilen Aminosäuren und ist als einzige proteinogene Aminosäure nicht chiral und damit nicht optisch aktiv.
Glycin ist nicht essentiell, kann also vom menschlichen Organismus selbst hergestellt werden und ist wichtiger Bestandteil nahezu aller Proteine und ein wichtiger Knotenpunkt im Stoffwechsel.
Der Name leitet sich vom süßen Geschmack reinen Glycins her (gr. γλυκύς: süß).
Inhaltsverzeichnis
Synthese
Glycin entsteht unter Anderem bei der Reaktion von Formaldehyd, Cyanwasserstoff und Wasser:
Diese Reaktion erlangt besondere Bedeutung durch die Hypothese, dass sich die Ausgangsstoffe aus der so genannten Uratmosphäre gebildet haben könnten, die die Erde vor ca. 4 Mrd. Jahren umgeben hat. Dabei verfügte sie über eine vermutlich aus Wasserstoff (H2), Helium (He) sowie in geringerem Maße aus Methan (CH4), Ammoniak (NH3) und einigen anderen Edelgasen bestehende Gashülle.
Chemisch kann Glycin auch aus Monochloressigsäure und Ammoniak hergestellt werden:
Im Körper wird das meiste Glycin mit der Nahrung aufgenommen, es kann aber auch aus Serin hergestellt werden.
Eigenschaften
Glycin liegt überwiegend als „inneres Salz“ bzw. Zwitterion vor, dessen Bildung dadurch zu erklären ist, dass das Proton der sauren Carboxylgruppe an das einsame Elektronenpaar des Stickstoffatoms der basischen Aminogruppe wandert:
Im elektrischen Feld wandert das Zwitterion nicht, da es als Ganzes ungeladen ist. Genaugenommen ist dies am isoelektrischen Punkt (bei einem bestimmten pH-Wert, hier 5,97[4]) der Fall, bei dem das Glycin auch seine geringste Löslichkeit in Wasser hat.
- van-der-Waals-Volumen: 48
- Hydrophobizitätsgrad: −0,4
Funktionen
Stoffwechsel
Die Umsetzung von Serin zu Glycin dient neben der Erzeugung von Glycin auch der Umsetzung von Tetrahydrofolsäure zu N5-N10-Methylen-Tetrahydrofolsäure, die unter Anderem für die Synthese von Thymin-Nukleotiden (DNA-Bestandteil) benötigt wird.
Auch für die Synthese von anderen Bestandteilen der Erbsubstanz (Purine) wird Glycin direkt benötigt. Es dient ebenfalls der Biosynthese von Häm (Sauerstoff-Bindung im Blut), Kreatin (Energiespeicher im Muskel) oder Glutathion.
Als sog. glucogene Aminosäure kann Glycin im Rahmen des Stoffwechsels über Pyruvat zu Glucose umgesetzt werden.
Als Nebenprodukt kann aus Glycin auch giftige Oxalsäure gebildet werden.
Proteinbestandteil
Aufgrund seiner geringen Größe wird Glycin bevorzugt in Polypeptide an räumlich beengten Positionen (der Protein-Sekundärstruktur) eingebaut.
Besonders häufig kommt es im Kollagen, dem häufigsten Protein in tierischen Organismen, vor. Hier macht es gut ein Drittel aller Aminosäuren aus, da es aufgrund seiner geringen Größe das Aufwickeln des Kollagens zu dessen Tripelhelix-Struktur erlaubt.
Nervensystem
Glycin wirkt im Zentralnervensystem über den Glycinrezeptor als inhibitorischer Neurotransmitter, also als hemmender Signalstoff. Die Wirkung erfolgt über die Öffnung von ligandengesteuerten Chlorid-Kanälen und führt so zu einem inhibitorischen postsynaptischen Potential (IPSP), was die Aktivität der nachgeschalteten Nervenzelle herabsetzt.
Am NMDA-Rezeptor hingegen wirkt es neben dem hauptsächlichem Agonisten Glutamat an einer speziellen Glycin-Bindungsstelle stimulierend.
Glycin freisetzende Nervenzellen (glycinerge Neurone) kommen vor allem im Hirnstamm und im Rückenmark[5] vor, in letzterem hemmen sie die sog. Motoneurone des Vorderhorns, wodurch es zu einer Herabsetzung der Muskelaktivität der von den Zellen innervierten Muskeln kommt.
Eine Herabsetzung der Glycinwirkung bewirken Strychnin, ein Antagonist des Glycinrezeptors, und das Tetanustoxin, welches die Freisetzung von Glycin hemmt. Der Wegfall der Hemmung erhöht die Muskelaktivität. Dadurch kann es zu lebensbedrohlichen Krämpfen kommen.
Verwendung
Als Geschmacksverstärker wird Glycin Lebensmitteln zugesetzt.
Glycin sowie sein Natriumsalz sind in der EU als Lebensmittelzusatzstoff der Nummer E 640 ohne Höchstmengenbeschränkung für Lebensmittel allgemein zugelassen, gesundheitliche Auswirkungen sind nicht bekannt.
Einzelnachweise
- ↑ a b c d Eintrag zu Glycin in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 13. Jan. 2008 (JavaScript erforderlich)
- ↑ Hans Beyer und Wolfgang Walter: Lehrbuch der Organischen Chemie, Hirzel Verlag, Stuttgart, 1991, ISBN 3-7776-0485-2, dort Seite 823.
- ↑ CRC Handbook of Chemistry and Physics, 1. Student Edition, Herausgeber: Robert C. Weast, S. C-706, CRC Press, Boca Raton, Florida, 1988, ISBN 0-8493-0740-6.
- ↑ P. M. Hardy: The Protein Amino Acids in G. C. Barrett (Herausgeber): Chemistry and Biochemistry of the Amino Acids, Chapman and Hall, 1985, ISBN 0-412-23410-6, S. 9.
- ↑ Prof. Georg Löffler, Dr. Petro E. Petrides, Prof. Peter C. Heinrich: Biochemie & Pathobiochemie, Springer Medizin Verlag, Heidelberg, 2006, ISBN 978-3-540-32680-9, Seite 1040
Literatur
- G. Löffler, P. E. Petrides: Biochemie und Pathobiochemie, 7. Auflage, Springer Verlag, 2003, ISBN 3-540-42295-1
Weblinks
Proteinogene AminosäurenAlanin | Arginin | Asparagin | Asparaginsäure | Cystein | Glutamin | Glutaminsäure | Glycin | Histidin | Isoleucin | Leucin | Lysin | Methionin | Phenylalanin | Prolin | Pyrrolysin | Selenocystein | Selenomethionin | Serin | Threonin | Tryptophan | Tyrosin | Valin
Wikimedia Foundation.