- Empirische Formel (Chemie)
-
Eine Verhältnisformel, auch Substanzformel oder empirische Formel genannt, gibt an, in welchem Zahlenverhältnis einzelne Atom- oder Ionensorten in einer chemischen Verbindung vorliegen. Ein anderes Mengenverhältnis kann hingegen in Form einer Molekül- oder Summenformel wiedergegeben werden. Die Verhältnisformel beschreibt damit einen Teil der chemischen Struktur von Verbindungen.
Inhaltsverzeichnis
Bestandteile der Verhältnisformel
Die Atomsorten werden in der Verhältnisformel durch die im Periodensystem (PSE) angegebenen Symbole bezeichnet. Das jeweilige Verhältnis wird durch tiefgestellte Zahlen gekennzeichnet, wobei eine 1 stets weggelassen wird.
Beispiel: die Verbindung Kupfer(I)-sulfid wird durch die Verhältnisformel Cu2S angegeben. Sie enthält Kupfer- und Schwefelteilchen (Ionen) im Verhältnis 2:1.
Verhältnis- und Molekül-/Summenformel
Die Verhältnisformel dient zur Beschreibung aller gitterartig aufgebauten Stoffe und gibt stets das kleinstmögliche Zahlenverhältnis an. Sie unterscheidet sich von der Summenformel (auch Molekülformel genannt), die die tatsächlichen Atomzahlen angibt. So hätte die Verbindung mit der Molekülformel P4O10 nur die Verhältnisformel {P2O5}.
Bestimmung und Anwendung der Verhältnisformel
Angewendet wird sie vor allem beim chemischen Rechnen (Stöchiometrie), zum Beispiel zur Berechnung der Stoffmengen- und Massenverhältnisse in Verbindungen oder bei chemischen Reaktionen über das Reaktionsschema.
Bei unbekannten chemischen Verbindungen werden die Verhältnisformeln mittels Elementaranalyse bestimmt, wobei die qualitative Elementaranalyse zur Ermittlung der vorhandenen Elemente dient (Nachweisreaktionen) und die quantitative Elementaranalyse zur Bestimmung der Verhältnisformel. Über die Bestimmung der molaren Masse gelangt man dann zur Summenformel der Verbindung.
+ Beispiel Molekül Summenformel Verhältnisformel Strukturformel Benzol C6H6 {CH} 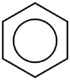
Bedeutung
Noch bis ins 20. Jahrhundert hinein hatten Verhältnisformeln eine große Bedeutung, da sie experimentell oft einfacher oder zuverlässiger zu bestimmen waren als die Summenformel oder Molekülformel. Die Verhältnisformel gab vielen Fällen den experimentellen Befund wieder, während die Molekülformeln bisweilen auf zusätzlichen Annahmen beruhten. Aufgrund der sehr genauen Strukturbestimmungsmethoden, die heute oft verwendet werden, liegt gerade für große aber wohldefinierte Proben der Fall bei gut ausgestatteten Labors bisweilen umgekehrt: bei Proteinen beispielsweise ist es sinnvoll, aus der Struktur die Molekülformel zu bestimmen, aus der die Verhältnisformel exakt abgeleitet werden kann – oft genauer als durch eine einfache Elementaranalyse.
Die Aussagekraft einer Molekülformel ist viel höher – insbesondere kann man aus der Molekülformel leicht die Verhältnisformel ableiten, während die Umkehrung nur mit Hilfe von zusätzlichen Angaben möglich ist. Daher haben Verhältnisformeln nur noch eine relativ geringe praktische Bedeutung für Moleküle. Für ionische Verbindungen ist dagegen zumeist nur die Angabe der Verhältnisformel sinnvoll.
Einführende Beispiele
Verhältnis- und Summenformeln für einfache anorganische Verbindungen
- Chlorwasserstoff: HCl
- Bariumchlorid: BaCl2
- Ammoniak: NH3
- Schwefelsäure: H2SO4
- Salpetersäure: HNO3
- Natriumhydroxid: NaOH
- Calciumhydroxid: Ca(OH)2
- Aluminiumoxid: Al2O3
- Wasser: H2O
- Ammoniumsulfid: (NH4)2S
- (Di-)Ammoniumcarbonat: (NH4)2CO3
Für Legierungen werden ebenfalls Verhältnisformeln verwendet, zum Beispiel Ni3Al.
Verhältnis- und Summenformeln für Kationen, Komplexe und Anionen
- Silberkation:
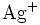
- Eisen-III-Kation:
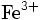
- Ammoniumion:
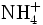
- Kupfertetramminkomplex:
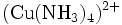
- Sulfid-Anion:
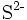
- Carbonat-Anion:
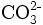
- Sulfat-Anion:
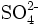
- Thiosulfat-Anion:
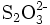
- Dichromat-Anion:
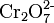
- Hexacyanoferrat(II)-ion:
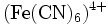
- Blutlaugensalz: K4(Fe(CN)6)
- Berliner Blau: Fe4(Fe(CN)6)3
Summenformeln für organische Verbindungen
- Essigsäure: C2H4O2
- Dimethylglyoxim: C2H4N2O2
Wikimedia Foundation.
