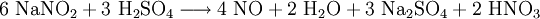- Endothelium-derived relaxing Factor
-
Strukturformel 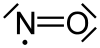
Allgemeines Name Stickstoffmonoxid Andere Namen - Stickstoffoxid
- Stickoxid
Summenformel NO CAS-Nummer 10102-43-9 PubChem 145068 ATC-Code R07AX01
DrugBank DB00435 Kurzbeschreibung farbloses Gas Eigenschaften Molare Masse 30,01 g·mol−1 Aggregatzustand gasförmig
Dichte 1,25 kg·m−3[1]
Schmelzpunkt −164 °C[1]
Siedepunkt −152 °C[1]
Dampfdruck entfällt[1]
Löslichkeit 60 mg·l−1 in Wasser (20 °C)[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 


Brand-
förderndSehr giftig Ätzend (O) (T+) (C) R- und S-Sätze R: 8-26-34 S: 9-17-26-28-36/37/39-45 Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln MAK 30 mg·m−3[2]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Stickstoffmonoxid ist ein farbloses und giftiges Gas mit der Formel NO.
Inhaltsverzeichnis
Eigenschaften
Das Stickstoffmonoxid (siehe auch Stickoxide) hat eine molare Masse von 30,01 g/mol, der Schmelzpunkt liegt bei −163,6 °C, der Siedepunkt bei −151,8 °C. Die kritische Temperatur für NO beträgt −93 °C und der kritische Druck liegt bei 6,4 MPa. In Wasser ist Stickstoffoxid wenig löslich. Unter Einwirkung von Sauerstoff und anderen Oxidationsmitteln wird NO sofort zu braunem Stickstoffdioxid oxidiert, das in Wasser zu Salpetersäure und Salpetriger Säure disproportioniert. Außer mit Iod reagiert es mit Halogenen zu Nitrosylhalogeniden. Unter Einwirkung von Schwefeldioxid wird Stickstoffoxid zu Distickstoffoxid reduziert.
Es ist schleimhautreizend, karzinogen und durch die Bildung von Methämoglobin toxisch.
Herstellung
Labortechnisch kann NO durch Reduktion von etwa 65-prozentiger Salpetersäure mit Kupfer gewonnen werden. Das Produkt ist aber relativ unrein. Reines Stickstoffmonoxid ist zugänglich:[3]
- aus einer Lösung von Kaliumnitrit und Kaliumiodid in Wasser, in die Schwefelsäure getropft wird:
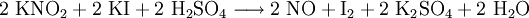
- Statt Kaliumiodid kann auch Kaliumhexacyanoferrat(II) verwendet werden:
![\mathrm{KNO_2 + K_4[Fe(CN)_6] + H_2SO_4 \longrightarrow NO + K_3[Fe(CN)_6] + K_2SO_4 + H_2O}](/pictures/dewiki/97/a607e83067de2a818767f1fb5c38a609.png)
- aus Nitrosylhydrogensulfat und Quecksilber
- aus Natriumnitrit und Schwefelsäure:
- aus Eisen(II)-sulfat und einer Mischung von Natriumbromid und Natriumnitrit. Das Endprodukt dieser einfachen Reaktion enthält 98,8% NO und 1,2% N2.
Industriell wird das Gas durch die katalytische Ammoniakverbrennung (Ostwald-Verfahren) gewonnen. Früher wurde das Gas großtechnisch auch durch sogenannte Luftverbrennung von Stickstoff und Sauerstoff in einem elektrischen Lichtbogen gewonnen. Die verwendeten Verfahren (Birkeland-Eyde-Verfahren, Schönherr-Verfahren, Pauling-Verfahren) zielten auf einen möglichst kurzen Kontakt der Gase mit dem sehr heißen Flammbogen ab, um so das Reaktionsgleichgewicht zum Stickstoffmonoxid zu verschieben. Da hierbei sehr viel elektrische Energie benötigt wird, sind die Verfahren nicht konkurrenzfähig zum Ostwaldverfahren und werden nicht mehr eingesetzt.
Verwendung
Technisch
Stickstoffoxid tritt als Zwischenprodukt bei der technischen Herstellung von Salpetersäure auf und wird zusammen mit Stickstoffdioxid zu Herstellung von Nitriten verwendet. Reinstes Stickstoffmonoxid wird als Prüfgas zur Kalibrierung von Messgeräten eingesetzt.
Medizinisch
Stickstoffmonoxid hat eine erweiternde Wirkung auf die Blutgefäße der Lunge.
Das Gasgemisch INOmax® des Herstellers Linde AG wurde 1999 durch die Food and Drug Administration (FDA) in den USA[4] und 2001 durch die Europäische Kommission in der EU[5] zugelassen für die Behandlung von Neugeborenen mit Lungenversagen mit hohem Blutdruck in der Lunge (hypoxisch respiratorische Insuffizienz, „Lungenhochdruck“). Es ist weltweit das erste medizinische Gas, das als Arzneimittel zugelassen wurde und enthält 100, 400 oder 800 ppm (0,01 %, 0,04 % oder 0,08 %) Stickstoffmonoxid als wirksamen Bestandteil, der Rest ist inerter Stickstoff. INOmax® wird als komprimiertes Gas in Aluminium-Gasflaschen vertrieben. Zur Anwendung wird es der Atemluft zugesetzt, die empfohlene Dosis liegt bei 20 ppm.[5][6]
Stickstoffmonoxid wirkt sehr schnell, wodurch lebensbedrohliche Komplikationen gut behandelt werden können. In der Herzchirurgie (Klappenerkrankungen, Herztransplantationen) kann NO verwendet werden um einen erhöhten pulmonalen Druck zu behandeln. Ein Wert von NO für die Behandlung des ARDS, einer schweren Lungenfunktionsstörung, die nach Lungenverletzungen, -entzündungen und Reizgasverätzungen auftreten kann, ist zweifelhaft.[7][8] Ferner wird NO eingesetzt bei bestimmten Operationen am Gehirn bei älteren Menschen.
Physiologische Bedeutung
Geschichte
Ende der 1970er-Jahre wurde der Pharmakologe Ferid Murad erstmals auf die physiologischen Wirkungen des Stickstoffmonoxid (NO) aufmerksam. Bei Untersuchungen mit organischen Nitraten – einer Substanzgruppe, die bei akuten Brustschmerzen eingesetzt wird – entdeckte er, dass diese NO freisetzen, welches eine Erweiterung (Vasodilatation) der Blutgefäße bewirkt. Auch der Pharmakologe Robert F. Furchgott untersuchte die Auswirkungen von Medikamenten auf die Blutgefäße. Er fand heraus, dass die innerste Gefäßschicht (Endothel) eine unbekannte Substanz (Faktor) produziert, die in der darunterliegenden Muskelschicht deren Erschlaffung (Relaxierung) herbeiführt. Da er die Substanz nicht bestimmen konnte, nannte er sie EDRF (Endothelium-derived relaxing Factor, von dem Endothel stammender, Gefäßmuskulatur-erschlaffender Faktor). Erst im Laufe der 1980er Jahre gelang es, die unbekannte Substanz EDRF zu entschlüsseln. Unabhängig voneinander identifizierten Louis J. Ignarro und Robert F. Furchgott EDRF als Stickstoffmonoxid.
1998 wurde der Nobelpreis für Physiologie und Medizin an die Amerikaner Robert Furchgott, Ferid Murad und Louis J. Ignarro verliehen. Den Forschern gelang es erstmals, die große Bedeutung des NO für die Blutversorgung von Organen und dessen Rolle als Botenstoff im Organismus nachzuweisen. Mit den Erkenntnissen über NO erschließen sich somit neue Möglichkeiten bei der Behandlung von Gefäßerkrankungen und den dadurch bedingten Organschäden.
Wirkung
Das freie Radikal NO, das von den Stickoxid-Synthasen (NOS) synthetisiert wird, reagiert letztlich zu Nitrit und/oder Nitrat. Stickoxid besitzt ein ungepaartes Elektron. Es ist elektrisch neutral und diffundiert daher frei durch cytosolische und membranöse Kompartimente. Trotz seiner radikalischen Eigenschaften hat Stickoxid eine ungewöhnlich lange Halbwertszeit von 2–3 s in biologischen Systemen und von etwa 400 s (bei einer Konzentration von 1 μM) in reinem Wasser (Hakim, Sugimori et al. 1996). Mathematische Modelle erlauben dabei den Schluss, dass Stickoxid - von einer punktförmigen Quelle für einige Sekunden freigesetzt - in biologischen Systemen etwa 200 μm diffundieren kann (Wood & Garthwaite 1994). Es wurde vorgeschlagen, dass Stickoxid das einzig bisher bekannte Radikal ist, welches unter biologischen Bedingungen eine ausreichende Stabilität besitzt, um als extrazellulärer „Messenger“ (Botenstoff) zu fungieren (Saran & Bors 1994).
Der Begriff „nitrosativer Stress“ wird in den letzten Jahren dem des oxidativen Stresses (siehe auch Reaktive Sauerstoffspezies) an die Seite gestellt (Stamler & Hausladen 1990; Hausladen, Privalle et al. 1996). Es zeigte sich, dass viele Erscheinungen der Zellpathologie, die bisher den Folgen eines oxidativen Stresses zugeordnet wurden, zumindest teilweise als Ergebnis einer gesteigerten Produktion des Stickoxids zu erklären sind. Zum anderen demonstrieren Experimente, dass die destruktiven Eigenschaften des Stickoxids nicht, wie längere Zeit angenommen, von diesem selbst stammen, sondern vielmehr durch eines seiner Folgeprodukte, das Peroxynitrit (ONOO-), vermittelt sind (Bartosz 1996). Peroxynitrit entsteht durch die diffusionslimitierte Reaktion von Superoxid (auch Hyperoxid genannt) und Stickoxid und ist aufgrund seines hohen Redoxpotentials wesentlich aggressiver als seine Vorläufermoleküle.
Ein Marker für nitrosativen Stress und oxidative Proteinschaedigung ist Nitrotyrosin. Wenn ONOO- Aminogruppen von Proteinen und Makromolekülen oxidiert werden, entstehen Nitroso-Aminosäurereste und nach Abbau oxidativ geschädigter Proteine mit NO-Tyr-Rest wird Nitrotyrosin freigesetzt. Werte ab 10 nmol/l Blut deuten auf nitrosativen Stress hin.
NO wird unter Verbrauch von NADPH durch NO-Synthasen (NOS) aus der Aminosäure L-Arginin und Sauerstoff hergestellt. Als weitere Endprodukte entstehen dabei Citrullin und Wasser. Es sind heute vier NOS-Isoformen identifiziert, von denen die endotheliale NOS (eNOS) und die neuronale NOS (nNOS) konstitutiv exprimiert werden, während die induzierbare NOS-Isoform (iNOS) auf transkriptioneller Ebene induzierbar ist. Alle vier Isoformen haben eine hohe Sequenz-Homologie zur Cytochrom P450-Reduktase und sind in spezifischen Zelltypen lokalisiert:
1. eNOS in den Zellen an der Innenseite von Blutgefäßen (Endothelzellen): NO bewirkt indirekt, durch Erhöhung des cGMP (Cyclisches Guanosinmonophosphat)-Spiegels die Relaxation der glatten Gefäßmuskulatur, was zu einer Vasodilatation und damit zu einer Absenkung der Nachlast des Herzens und des Blutdrucks führt. Durch diese Reaktion wurde die Wirkungsweise einer ganzen Gruppe von Medikamenten verständlich, darunter Amylnitrit, Nitroprussid und Nitroglycerin. Diese Medikamente setzen NO im Körper frei. Der gleiche Mechanismus liegt bei der diätetischen Behandlung von Arteriosklerose-Patienten mit Arginin selbst zugrunde. Das gasförmige NO wird im Rahmen spezieller Herzkatheteruntersuchungen verabreicht, um die Reaktion der Lungengefäße darauf zu testen.
2. iNOS in Makrophagen/Mikrogliazellen: Eine weitere Wirkung von NO ist der Schutz des Körpers vor Eindringlingen. So produzieren Makrophagen große Mengen von NO, das Bakterien und Zellen abtötet. Eine übermäßige Produktion von NO durch die Makrophagen kann auch Nebenwirkungen haben. So ist die gefährliche Absenkung des Blutdrucks bei einem septischen Schock zu erklären.
3. nNOS in Neuronen: NO ist auch im Gehirn nachweisbar. Dort übernimmt es die Funktion eines Neurotransmitters, wobei es unter anderem die Synthese von cGMP erhöht. Das kleine Molekül kann leicht in Zellen hinein- und hinausdiffundieren, da es membrangängig ist. Man vermutet auch, dass NO, bedingt durch seine schnelle Diffusion, relativ große Areale des ZNS modulieren kann.
4. mtNOS in Mitochondrien: mtNOS ist ein Stoffwechselmodulator für Synthese, Proliferation, Apoptose und Regulation des Sauerstoffverbrauchs. Die Einordnung als eigene Isoform ist fraglich, da die mtNOS eher als eine Splicing-Variante der nNOS angesehen wird.
Physiologische Anpassung
Tibeter verfügen als Anpassung an das Leben im Hochland um 4000 Meter über zehnmal so viel NO im Blut wie Bewohner auf 200 Meter über dem Meeresspiegel, was zu einer Verdoppelung des Blutflusses im Vergleich zu Tiefland-Bewohnern führt und hierdurch zu einer optimierten Versorgung mit Sauerstoff.[9]
Einzelnachweise
- ↑ a b c d e f Sicherheitsdatenblatt (praxair)
- ↑ Sicherheitsdatenblatt (air liquide)
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 485-7.
- ↑ FDA Approval, Review March 2001 (englisch)
- ↑ a b Europäischer öffentlicher Beurteilungsbericht (EPAR) und Produktinformation zu INOmax auf der Website der Europäischen Arzneimittelagentur (EMEA)
- ↑ Fachinformation für USA (englisch)
- ↑ N.K. Adhikari et. al.: Effect of nitric oxide on oxygenation and mortality in acute lung injury: systematic review and meta-analysis. British Medical Journal 2007 Apr 14;334(7597):779. PMID 17383982
- ↑ H.R. Bream-Rouwenhorst et. al.: Recent developments in the management of acute respiratory distress syndrome in adults. American Journal of Health System-Pharmacy 2008 Jan 1;65(1):29-36. PMID 18159036
- ↑ S. C. Erzurum u.a.: Higher blood flow and circulating NO products offset high-altitude hypoxia among Tibetans. PNAS 104, November 2007, S. 17593–17598, doi:10.1073/pnas.0707462104
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.