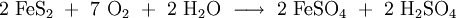- FeSO4
-
Strukturformel 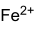
Allgemeines Name Eisen(II)-sulfat Andere Namen - Eisensulfat
- Eisensulphat
- Eisenvitriol
- Schwefelsaures Eisenoxydul
- Eisenoxydulsulfat
- grüner Vitriol
Summenformel FeSO4 CAS-Nummer 7720-78-7 (wasserfrei)
7782-63-0 (Heptahydrat)ATC-Code B03AA07
Kurzbeschreibung weißer Feststoff (wasserfrei)
hellbläulicher bis blassgrüner Feststoff (Heptahydrat) [1]Eigenschaften Molare Masse 151,91 g·mol−1 (wasserfrei)
278 g·mol−1 (Heptahydrat)Aggregatzustand fest
Dichte 2,84 g·cm−3 (wasserfrei)
1,89 g·cm−3 (Heptahydrat) [1]Schmelzpunkt Löslichkeit Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22-36/38 S: (2)-46 Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln LD50 319 mg·kg−1 (Ratte, oral)[3]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Eisen(II)-sulfat (auch: Ferrosulfat, Grünsalz, Eisenvitriol) ist ein zweiwertiges Eisensalz der Schwefelsäure. Der Name Grünsalz für Eisen(II)-sulfat-Heptahydrat (FeSO4 · 7 H2O) leitet sich von der grünlichen Farbe des Salzes ab.
Inhaltsverzeichnis
Vorkommen und Herstellung
Die Herstellung erfolgt durch Erhitzen von pulverisiertem Eisen in 20 %iger Schwefelsäure:
Nach Beendigung der Wasserstoffentwicklung wird eingeengt und heiß abfiltriert.
Einengen oder Eindampfen bedeutet, dass die vorliegende Lösung erhitzt wird und Wasser verdampft. Die Salzkonzentration steigt über die Löslichkeit bei 20 °C. So kann man nach Filtrieren und Abkühlen beobachten, wie sich Salzkristalle bilden, da sie das Salz in der Kälte schlechter löst als in der Wärme. Diese Salzkristalle beschleunigen als so genannte Impfkristalle den Kristallbildungsprozess. So bilden sich nach längerem Warten auch größere Kristalle.
Eisen(II)-sulfat kann auch kommerziell durch Oxidation von Pyrit gewonnen werden.
Bei der Produktion von Titandioxid mit dem Sulfatverfahren entsteht als Sekundärprodukt in großen Mengen ebenfalls Eisen(II)-sulfat. Die größten Mengen entstehen in Deutschland in den Produktionsbetrieben in Leverkusen und Nordenham von Kronos International, Inc. Ferner entsteht es auch beim Beizen von Eisenblechen.
In der Natur kommt Eisensulfat als Mineral Melanterit vor, es ist ein Verwitterungsprodukt von Pyrit. Es kommt dabei in verschiedenen Hydratformen vor, welche ebenfalls in der freien Natur auftreten.
- FeSO4·H2O (Mineral: Szomolnokit, relativ selten)
- FeSO4·4 H2O (Mineral: Rozenit, weiß, relativ verbreitet, Dehydratationsprodukt von Melanterit)
- FeSO4·5 H2O (Mineral: Siderotil, relativ selten)
- FeSO4·6 H2O (Mineral: Ferrohexahydrit, relativ selten)
- FeSO4·7 H2O (Mineral: Melanterit, Blue, relativ verbreitet)
Eigenschaften
Eisensulfat kristallisiert aus wässrigen Lösungen als hellgrüne Kristalle, die 7 Mol Kristallwasser enthalten: FeSO4 · 7 H2O, daher auch der Name Eisen(II)-sulfat-heptahydrat, es ist nur in sehr reinem Zustand hellblau, die grünliche Farbe entsteht durch teilweise Oxidation zu Eisen(III)-sulfat. An trockener Luft verwittern die Kristalle, diese Kristallwasserabspaltung gelingt vollständig bei längerem Erhitzen über 70 °C, dabei entsteht das Monohydrat als farbloses Pulver FeSO4 · H2O, welches bei starkem Erhitzen ab etwa 400 °C zu basischem Eisen(III)-sulfat und Schwefeldioxid zerfällt. Eisensulfat ist gut wasserlöslich, aber so gut wie unlöslich in Ethanol und Aceton.
Historische Verwendung
Kupferwasser
Kupferwasser ist eine alte Bezeichnung für unreines (kupferhaltiges) Eisenvitriol.[4]
Perser, Meder, Assyrer und Hebräer schrieben auf ungegerbte Häute mit Tusche aus Ruß und Öl, auf gegerbte Häute aber mit einer verdickten Lösung von Kupferwasser (chalcantum), in beiden Fällen übereinstimmend mit Schreibrohr (calamus, von griechisch kalamos), was später zu den alaunten Häuten und 183 v. Chr. den König Eumenes II. von Pergamos zu der Bereitung des danach benannten Pergaments führte.[5]
Im Jahr 1501 gehörte gemäß der Schrift „Summarische Extrakt und beschreybung der Khauf-Handels und Schefleuth im Lands Bayrn“ Kupferwasser zu den Gütern, die auf der Loisach verzollt wurden.[6]
1818 wies die schweizerische Chemische Fabrik Uetikon folgendes Inventar aus: „lb 5766 Kupferwasser, lb 5511 Vitriolöl, lb 650 Cyprisches Vitriol“; sodann Materialien: „lb 700 Kupfer, lb 6212 Schwefel, lb 350 Salpeter“.[7]
Heilmittel
Eisensulfat findet sich in der Rezeptur bekannter Heilmittel des Mittelalters wie beispielsweise des Theriaks, das aus über 60 Bestandteilen (pflanzliche Auszügen, Opium, Gewürze, Schlangenfleisch u. a.) bestand.
Moderne Verwendung
- Im Labor und in der Synthesechemie ist es ein wichtiger Ausgangsstoff zur Herstellung von weiteren Eisenverbindungen.
- Zur Entschwefelung:
- Bei langen Abwasserkanalstrecken und Abwasserdruckleitungen kommt es in den wärmeren Jahreszeiten immer wieder zu Geruchsproblemen. Ursache ist die Bildung von Schwefelwasserstoff. Die Bildung von Schwefelwasserstoff kann mit Eisen(II)-sulfat verhindert werden.
- Biogasanlagen haben ebenfalls mit der Bildung von Schwefelwasserstoff zu kämpfen. Hier wird Eisen(II)-sulfat zur Biogasentschwefelung eingesetzt.
- Es wird auch zur Kohleentschwefelung eingesetzt. In der analytischen Chemie werden Nitrate und Nitrite mit Eisensulfatlösung qualitativ nachgewiesen und zwar durch die so genannte Ringprobe, beim Unterschichten der eisensulfathaltigen Probelösung mit konzentrierter Schwefelsäure bildet sich an der Grenzfläche ein brauner Ring von Eisennitrososulfat. Die quantitative Titration mit Eisensulfat-Maßlösung wird wegen der Instabilität der Lösung bezüglich der Oxidation durch Luftsauerstoff nur selten angewendet.
- Als Neutralisator:
- Bei der Abwasserreinigung dient es als Fäll- und Flockungsmittel. Besonders große Kläranlagen verwenden häufig Eisen(II)-sulfat zur Phosphatelimination. Das liegt daran, dass die Aufbereitung einer dosierfähigen Eisen(II)-sulfat-Lösung einen aufwendigen Lösebunker benötigt. Kleinere Kläranlagen verwenden normalerweise bereits industriell hergestellte zwei- oder dreiwertige Lösungen, die aus einem Lagertank heraus dosiert werden können. Für die Herstellung der dreiwertigen Eisen(III)-chloridsulfat-Lösung dient als Rohstoff Eisen(II)-sulfat.
- In der Bauwirtschaft wird es bei Bedarf chromathaltigem Zement zur Reduktion des CrVI zu CrIII zugesetzt als Chromatreduzierer.
- Als Eisen- und Schwefelquelle:
- Im Düngemittelbereich wird getrocknetes Eisen(II)-sulfat dem Rasendünger beigemischt. Dies führt zur Bekämpfung von Moosen.
- Als Farbmittel:
- Früher wurde mit einem Gallapfelsud, (welcher Gallussäure enthält) unter Zugabe von Eisensulfat schwarze Eisengallustinte hergestellt. Diese verursacht auf lange Sicht jedoch Tintenfraß in den Pergamenten, da das Eisensulfat bei der Verwitterung Schwefelsäure freisetzt.
- Als Grubenocker diente es als Pigment, ist aber wegen seines Schwefelanteils von minderer Qualität.
- Als Dünger:
- In der Landwirtschaft.
Quellen
- ↑ a b c d Eintrag zu Eisen(II)-sulfat in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 3. Januar 2008 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 7720-78-7 im European chemical Substances Information System ESIS
- ↑ Sicherheitsdatenblatt (Carl Roth)
- ↑ http://www.retrobibliothek.de/retrobib/seite.html?id=130317
- ↑ Wikipediartikel Geschichte der Schriftmedien
- ↑ http://www.flossfahrt.de/geschichte.htm
- ↑ Wikipediaartikel Schweizer Wirtschaft
Weblinks
Wikimedia Foundation.