- Feuerlöschmittel
-
Löschmittel haben die Aufgabe brennende Stoffe unter Berücksichtigung ihrer Brandklasse und vorherrschender Umfeldbedingungen (beispielsweise Personengefährdung oder Raumgröße) zu löschen. Sie werden zur Brandbekämpfung von den Feuerwehren oder in automatischen Feuerlöschanlagen eingesetzt oder stehen zur Selbsthilfe in tragbaren Feuerlöschern oder mobilen Feuerlöschgeräten zur Verfügung.
Jedes Löschmittel besitzt eine Hauptlöschwirkung und eventuell Nebenlöschwirkungen. Die falsche Auswahl des Löschmittels kann fatale Folgen haben. Zum Beispiel reagieren einige chemische Stoffe mit Wasser (mögliche Folge: Explosionsgefahr) und die Moleküle einiger chemischer Löschmittel werden bei hohen Temperaturen aufgebrochen und gehen neue Verbindungen ein (mögliche Folge: Säurebildung).
Inhaltsverzeichnis
Wasser
Das Löschmittel Wasser ist geeignet für die Brandklasse A. Das Löschmittel hat gegenüber anderen Löschmitteln Vorteile: es ist preisgünstig, nicht giftig, pH neutral, nicht ätzend, meistens ausreichend vorhanden und einfach zu fördern.
Wasser darf nicht bei brennenden Metallen benutzt werden, da die enorme Hitze das Wasser chemisch aufspalten würde - der enthaltene Sauerstoff würde das Feuer explosionsartig anfachen und der Wasserstoff verbrennen; unter Umständen kann es auch durch die Mischung des Wasserstoffes mit Luftsauerstoff zur Bildung von hochexplosivem Knallgas kommen (Die allgemein verbreitete Auffassung, dass die Hauptgefahr die Knallgasbildung beträfe, ist nicht zutreffend. Sondern: Heißes Leichtmetall = Reduktionsmittel → Aufspaltung der Wassermoleküle → exotherme Redoxreaktion Leichtmetall + Sauerstoff).
Bei Schornsteinbränden würde Wasser wegen der im Schornstein sehr beengten Raumverhältnisse unter großem Druck verdampfen, 1 Liter Wasser ergibt 1.700 Liter Wasserdampf, und den Schornstein zerstören. Bei Bränden von Fetten und Ölen mit Temperaturen oberhalb von 100 °C ist zu beachten, dass ein Ölnebel entsteht der explosionsartig verbrennt, da bei Kontakt das Wasser verdampft und das brennende Öl/Fett verspritzt, die gefürchtete Fettexplosion. Die elektrische Leitfähigkeit von Wasser birgt die Gefahr, mit Hochspannung in Kontakt zu kommen und einen elektrischen Schlag zu erleiden.
Hauptlöschwirkung: Abkühlen
Nebenlöschwirkung: ErstickenWasser mit Zusätzen
Netzmittel / Netzwasser
Ein Netzmittel ist ein Zusatz zum Löschwasser für die Herabsetzung der Oberflächenspannung des Wassers. Die fertige Mischung wird "Netzwasser" genannt. Als Netzmittel wird normalerweise Schaummittel verwendet, es wird dann lediglich niedriger dosiert und keine Luft zugemischt. Übliches Mehrbereichsschaummittel, das zur Schaumerzeugung mit 3 % zugemischt wird, kann z. B. bereits in einem Bereich von ca. 0,5 % - 1 % als Netzmittel eingesetzt werden.
Alternativ zum Schaummittel kann man das Netzwasser auch mit handelsüblichem Geschirrspülmittel herstellen, welches man z. B. in einem Eimer mit etwas Wasser vermischt und dann durch den Zumischer zuführt. Die erforderliche Zumischrate ist dabei selbst zu ermitteln.
Netzmittel wird zugesetzt, um durch Herabsetzen der Oberflächenspannung das Eindringen des Löschmittels in das Brandgut zu verbessern oder erst zu ermöglichen. Damit sollen auch tief oder versteckt liegende Glutbrände, wie sie zum Beispiel im Humusboden im Wald oder in Spänebunkern auftreten, erreicht werden.
In jüngster Zeit setzt sich immer mehr die Erkenntnis durch, dass durch den Einsatz von Netzmittel auch Brände in Gebäuden, für die früher reines Wasser verwendet wurde, effizienter bekämpft werden können. Geschulte Strahlrohrführer vorausgesetzt, lassen sich Löschwasserschäden durch abfließendes Löschwasser vermindern, da das Wasser besser in das Brandgut eindringt und nicht aufgrund der Oberflächenspannung hauptsächlich abfließt.
Gelegentlich wird der Begriff "Light Water" für Netzwasser benutzt. "Light Water" ist jedoch ein Markenname der Firma 3M für ein früher sehr verbreitetes AFFF-Schaummittel. Die Begriffsverwirrung mag daher kommen, dass man AFFF bei Flüssigkeitsbränden auch als unverschäumtes Schaummittel-Wasser-Gemisch aufbringen kann, was auch z. B. bei eingebauten Kompaktlöschanlagen in kleineren Fahrzeugen (z. B. "Poly"-Löschanlage in VRW) oft der Fall war bzw. ist. Das Wirkprinzip bei dieser Anwendung ist jedoch ein anderes, die "Netzwirkung" kommt nur bei festen Brennstoffen zum Tragen.
Gelbildner
Wenn eine hohe Haftfähigkeit und eine höhere Viskosität des Löschwassers erforderlich erscheint, können dem Gelbildner zugesetzt werden. Diese Zusätze basieren in der Regel auf Superabsorbern und können als Pulver oder Emulsion vorgehalten werden. Diese Gelbildner sollen beispielsweise bei sogenannten "DSD-Bränden" (Brände von gelagertem Verpackungsabfall) gute Erfolge erzielen und ermöglichen bei Schüttgütern die Schaffung einer luftdichten Sperrschicht, die deutlich stabiler ist als ein Schaumteppich, länger bestehen bleibt und deutlich weniger Wasser an das Brandgut abgibt.
Retardants
Retardants sind Zusätze zum Löschwasser, die vor allem zur Brandbekämpfung bei Vegetationsbränden mit Flugzeugen eingesetzt werden. Sie sollen beispielsweise die Verdunstung vermindern, den Siedepunkt erhöhen und durch ihre Farbe die Stellen, auf die bereits Löschmittel aufgebracht wurde, besser erkennbar machen.
Salze
Salze erhöhen den Siedepunkt des Wassers und erhöhen so die Löschkraft. Salze sind eher in Handfeuerlöschern gebräuchlich als im Einsatz der Feuerwehren.
Löschschaum
Löschschaum (Details siehe eigener Artikel) ist ein Löschmittel, das durch Zusetzen eines Schaummittels zum Wasser mit anschließend zugeführter Luft erzeugt wird. Löschschaum wirkt erstickend, indem er eine Luft undurchlässige Schicht über den brennbaren Stoff legt. Je nach dem Verhältnis des Wasser-Schaummittel-Luft-Gemisches werden drei Arten unterschieden.
Bezeichnung Verschäumungszahl Schwerschaum bis zu 20fache Verschäumung (praxisrelevant erst ab ~4fach) Mittelschaum über 20fache bis 200fache Verschäumung Leichtschaum über 200fache bis 1000fache Verschäumung Hauptlöschwirkung: "Ersticken" (hier: Stickeffekt durch Trennen)
Nebenlöschwirkung: AbkühlenDruckluftschaum
Das Druckluftschaum-Verfahren (auch bezeichnet als CAFS: Compressed Air Foam System) unterscheidet sich durch die Art der Zuführung der zur Schaumbildung benötigten Luft. Wie der Name sagt, wird die Luft als Druckluft dem Wasser/Schaum-Gemisch zugeführt. Dies geschieht im Feuerwehrfahrzeug, beziehungsweise bei stationären Anlagen an einer Pumpe beziehungsweise einem Schaummittelzumischer, der Schaum wird komplett fertig durch die Schläuche zum Strahlrohr gefördert. Bei herkömmlichen Verfahren würde die Luft erst am Schaumrohr aufgenommen werden.
Löschpulver
Löschpulver sind Gemengee pulverförmiger Chemikalien, die eine Verbrennung unterbinden. Die Unterbindung geschieht entweder durch Erstickung (Brandklassen A+D) und/oder Inhibition (Brandklasse B+C). Es werden drei Arten differenziert:
Bezeichnung Geeignet für Brandklasse Löschwirkung ABC-Pulver A, B, C - alles (außer Fett und Metallbrand) Inhibition (Flammen), Ersticken (Glut) BC-Pulver B, C - Flüssigkeiten (außer Fett) und Gase Inhibition D-Pulver (Metallbrandpulver) D - Metallbrand Ersticken Inertgase
Die Löschwirkung von Argon, Stickstoff und Kohlenstoffdioxid (prinzipiell kein Inertgas und daher für Brände der Brandklassen D nicht geeignet) wird durch die Verdrängung des Luftsauerstoffes erreicht. Man spricht hier vom Stickeffekt, der bei Unterschreitung des für die Verbrennung erforderlichen spezifischen Grenzwertes eintritt. In den meisten Fällen erlischt das Feuer schon bei einer Sauerstoffabsenkung auf 13,8 Vol.-%. Dazu muss das vorhandene Luftvolumen nur um etwa ein Drittel verdrängt werden, was einer Löschgaskonzentration von 34 Vol.-% entspricht. Bei Brandstoffen, die zur Verbrennung erheblich weniger Sauerstoff brauchen, ist eine Erhöhung der Löschgaskonzentration erforderlich, beispielsweise bei Ethin, Kohlenmonoxid und Wasserstoff. Da die Löschgase Argon und Kohlendioxid schwerer sind als die Umgebungsluft, durchsetzen sie den Flutungsbereich besonders schnell und gründlich.
Zur Verbesserung der Löscheigenschaften werden auch Mischungen der vorhergenannten Gase verwendet, wie etwa Inergen.
Kohlenstoffdioxid
Kohlenstoffdioxid ist für Brände der Brandklassen B und C geeignet. Aufgrund seiner physikalischen Eigenschaften wird Kohlenstoffdioxid als einziges Löschgas auch in Feuerlöschern und Feuerlöschgeräten eingesetzt. In stationären Feuerlöschanlagen wird Kohlenstoffdioxid druckverflüssigt in Hochdruckstahlflaschen oder gekühlt bei −20 °C in großen Niederdruckbehältern gelagert. Durch die Flüssiglagerung können deutlich größere Löschmittelvorräte platzsparend vorgehalten werden. Da Kohlenstoffdioxid bei hohen Konzentrationen gesundheitsschädlich ist, schreiben die Berufsgenossenschaften bei Überschreitung des Grenzwertes von mehr als 5 Vol.-% besondere Schutzmaßnahmen vor. Es wird vor allem auch in elektrischen und elektronischen Anlagen eingesetzt, da es im Gegensatz zu allen Wasser-basierten Löschmitteln und den meisten Pulvern nicht elektrisch leitend ist. Durch die extreme Kälte werden jedoch magnetische Datenträger zerstört. Bei der Anwendung muss darauf geachtet werden, dass Kohlenstoffdioxid ein Atemgift ist und auf das Atemzentrum von Mensch und Tier wirkt.
Kohlenstoffdioxid kann nicht zum Löschen brennender Leichtmetalle (Alkali- und Erdalkalimetalle) eingesetzt werden, da es zu Sauerstoff und Kohlenstoff (oder Kohlenstoffmonoxid) zersetzt wird (Redoxreaktion). Auf älteren Kohlenstoffdioxidlöschern findet sich auch die Bezeichnung Kohlensäurelöscher.
Hauptlöschwirkung: Ersticken
(Nebenlöschwirkung: Abkühlen – praktisch aber kaum relevant)Argon
Argon ist ein aus der Umgebungsluft gewonnenes Edelgas, das als Löschmittel für Stationäre Feuerlöschanlagen gasförmig verdichtet in Hochdruckstahlflaschen gelagert wird. Der maximale Betriebsdruck liegt bei 300 bar. Argon ist nicht giftig. Allerdings kann beim Aufbau der erforderlichen Löschkonzentration, insbesondere im Zusammenhang mit einem Brandereignis, eine Gefährdung durch Brandgase und Sauerstoffmangel entstehen. Es ist zu 0,93 Vol.-% in der Atmosphäre enthalten. Seine Dichte im Verhältnis zur Luft beträgt 1,38:1.
Hinweis: Bei hoher Löschkonzentration kann im Einsatzfall eine Personengefährdung durch Sauerstoffmangel entstehen.
Hauptlöschwirkung: Ersticken
Stickstoff
Stickstoff ist ein farb-, geruch- und geschmackloses Gas, das zu 78,1 Vol.-% in der Atmosphäre enthalten. Seine Dichte im Verhältnis zu Luft beträgt 0,967:1. Als Löschmittel für Stationäre Feuerlöschanlagen wird Stickstoff gasförmig verdichtet in Hochdruck-Stahlflaschen gelagert. Bei einer Umgebungstemperatur von +15 °C liegt der maximale Betriebsdruck zur Zeit bei 300 bar. Stickstoff ist nicht giftig. Allerdings kann auch hier beim Aufbau der erforderlichen Löschkonzentration, insbesondere im Zusammenhang mit einem Brandereignis, eine Gefährdung durch Brandgase und Sauerstoffmangel entstehen.
Hinweis: Bei hoher Löschkonzentration kann im Einsatzfall eine Personengefährdung durch Sauerstoffmangel entstehen.
Hauptlöschwirkung: Ersticken
Halone (chemisch wirkende Löschgase oder -flüssiggase)
Nachdem durch das Montreal-Protokoll die verbliebenen Halone 1211 (Bromchlordifluormethan) und 1301 (Bromtrifluormethan) vom Markt verschwanden, haben einige Unternehmen (z. B. DuPont, 3M, Great Lakes Chemical Corporation) heute wieder „neue“ Halone zu Feuerlöschzwecken im Programm, die hinsichtlich ihrer ozonschädigenden Wirkung (ODP) problemlos sein sollen. Zumindest teilweise haben diese Halone auch bereits eine EU-Zulassung erhalten. Es handelt sich dabei insbesondere um die Halone
- Trifluormethan (HFC-23, Halon 1300, Markenname Trigon)
- Pentafluorethan (HFC-125, Halon 2500)
- 1,1,1,2,3,3,3-Heptafluorpropan (HFC-227ea, Halon 3700, Markennamen: FM-200 (Great Lakes Chemicals), FE-227 (DuPont Corporation), Solkaflam 227 (Solvay Fluor GmbH))
- 1,1,1,3,3,3-Hexafluorpropan (HFC-326fa, Halon 3600)
- Chlortetrafluorethan (HCFC-124, Halon 2410)
- sowie die untenstehenden Stoffe
Löschwirkung
Halone (halogenierte Kohlenwasserstoffe) löschen durch Störung des Verbrennungsablaufs, indem sie zu einer Kettenabbruchreaktion führen (Homogene Inhibition). Dieses Verfahren erfordert im Gegensatz zum Ersticken durch Inertgase und CO2 bedeutend weniger Löschmittelvolumen. Nicht zu vergessen ist jedoch ihre gegenüber CO2 zum Teil überaus starke Wirkung als Treibhausgas. Auch ist, insbesondere bei längeren Vorbrennzeiten der Brandklasse A, eine Zersetzung zu giftigen Folgeprodukten möglich bzw. wahrscheinlich.
Novec 1230
Novec ist eingetragenes Warenzeichen der Firma 3M.
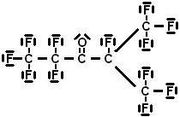
Das Löschmittel Novec 1230 (ISO-Kennzeichnung FK-5-1-12, genutzt in den Anlagentypen: Minimax MX 1230, SAPPHIRE, Kidde KD1230) ist eine farblose, fast geruchlose Flüssigkeit, die im Molekül Kohlenstoff, Fluor und Sauerstoff enthält (chem. Formel CF3CF2C(O)CF(CF3)2) und erst an der Löschdüse ausgetragen, gasförmig wird. Streng genommen handelt es sich nicht um ein Halon, sondern um ein fluoriertes Keton (perfluoriertes Ethyl-Isopropylketon). Die Löschwirkung des in stationären Feuerlöschanlagen eingesetzten Novec 1230 beruht, wie bei jedem Halon, auf homogener Inhibition. Das Molekül besitzt keine elektrische Leitfähigkeit und es verdampft innerhalb von Minuten. Es hat mit einen Treibhauspotenzial (CO2-Äquivalent) von 1 den geringsten Wert aller aktuell zugelassenen chemischen Löschmittel und zerfällt innerhalb weniger Tage unter Sonneneinstrahlung.[1]
Novec 1230 hat folgende physikalische Eigenschaften:
- Siedepunkt: 49 °C
- Gefrierpunkt: -108 °C
- Dampfdruck: 40,4 kPa (bei 25 °C)
- Verdampfungswärme: 95 kJ/kg (von 25 °C)
Halon 1211 und 1301
Aufgrund ihrer umweltschädigenden Wirkungen sind die früher sehr gebräuchlichen Halone 1211 (Bromchlordifluormethan, BCF, Freon 12B1, Formel CF2ClBr) und 1301 (Bromtrifluormethan, BTM, Freon 13B1, Formel CF3Br) durch das Montrealer Protokoll verboten und als Löschmittel nur noch in Ausnahmefällen für militärische Anwendungen, als Löschmittel im Rennsport sowie in der Luftfahrt zugelassen. Halon 1211 wurde hauptsächlich in Handfeuerlöschern, Halon 1301 vor allem in stationären Löschanlagen eingesetzt.
ältere Halone (geschichtlich)
Früher (vor 1980) kamen noch andere, meist weitaus giftigere, Halone zum Einsatz; insbesondere:
Tetrachlorkohlenstoff (Tetra, Halon 1400) Tetra war bis über die Mitte des 20. Jahrhunderts ein weit verbreitetes Löschmittel in Handfeuerlöschern. Durch Beimischung von 6 % Trichlorethylen könnte eine Frostbeständigkeit von bis zu -35 °C erreicht werden, was besonders für KFZ-Bordfeuerlöscher wichtig war. Diese Mischung konnte auch mit dem festen Hexachlorethan (seinerzeit noch "Hexachlorethylen" genannt) angereichert werden, was nach dem Verdampfen der flüchtigeren Tetras übrig blieb, sich erst bei 185 °C verflüchtigte und so einen nachhaltigen Löscherfolg sicherte. Dieser Zusatz hatte sich besonders bei hölzernen Funktürmen bewährt, da leitende Löschmittel dort nicht in Frage kamen.
Bromid (Die Namensgebungen sind historisch bedingt und können der aktuellen Nomenklatur daher widersprechen!)
"Bromid" wurde als Bezeichnung für verschiedene als Löschmittel verwendete Bromkohlenwasserstoffe benutzt. Sie waren in der Regel löschkräftiger, zumindest zum Teil jedoch auch stärker narkotisierend als Tetra:
Methylbromid`` (CH3Br, Brommethan) hatte eine sehr gute Löschwirkung, der Strahl zerstäubte und verdampfte jedoch sehr schnell, so dass es später häufig mit höher siedenden Stoffen gemischt wurde. Außerdem ist Methylbromid sehr giftig, was zu einigen Verletzten und Todesfällen führte.
Methylenbromid (CH2Br2, Dibrommethan).
Ethylenbromid (C2H4Br2, Dibromethan) wurde in Mischung mit Methylbromid angeboten und je nach Hersteller Ardexin oder 'Minimaxin genannt.
Ethylbromid (C2H5Br).
Monochlormonobrommethan (Halon 1011) als technisches Gemisch von ~80 % Monochlorbrommethan, ~10 % Methylenchlorid (CH2Cl2) und ~10 % Methylenbromid CH2Br2), seinerzeit sehr häufig vertrieben und eingesetzt unter der Bezeichnung CB. Reines Monochlormonobrommethan war sehr teuer in der Herstellung und erschien daher unwirtschaftlich. CB war insofern sehr fortschrittlich, als dass es kein Methylbromid enthielt und drucklos handhabbar war. Auch war "CB" sicherer als Tetra und Bromid, da es nicht zur Bildung von Phosgen oder Bromphosgen kommen konnte. In der DDR wurde ab 1956 ein ähnliches und von der Wirkung her vergleichbares Gemisch unter der Bezeichnung Pyrexin (später Emixin) hergestellt. Waren pro m³ Brandraum noch 500 g Kohlendioxid oder 560 g tetra erforderlich, so reichten 260 g Minimaxin und gar nur 232 g Exmixin für den Löscherfolg aus.
Jodkohlenwasserstoffe haben zwar eine hervorragende Löschwirkung, erlangten wegen ihres exorbitant hohen Preises (in den 1950ern etwa Faktor 10 gegenüber Bromkohlenwasserstoffen) jedoch niemals Bedeutung.
Fluorkohlenwasserstoffe Dichlordifluormethan (CCl2F2) und Dichlordifluorethan (C2Cl2F2) wurden bereits in der ersten Hälfte des 20. Jahrhunderts als Feuerlöschmittel patentiert. Über eine tatsächliche Verwendung ist jedoch wenig bekannt. Ähnliches gilt für Chlorbromjodfluormethan (CClBrJF) und Dibromdifluormethan (CBr2F2).
Alternative Löschmittel
Behelfmäßig können bei Metallbränden auch Zementpulver, Streusalz, trockener Sand, oder Graugussspäne als Löschmittel eingesetzt werden.
Historisches
Frühe chemische Löschmittel
Erste Versuche mit chemischen Löschmitteln wurden schon in der Mitte des 19. Jahrhunderts unternommen. Zur Löschung bzw. Unterdrückung eines ausgebrochenen Brandes in kleinen, abschließbaren Räumen wurde so genannte "Bucher´sche Feuerlöschdosen" verwendet, die durch ihren Inhalt (8 Teile Salpeter, 4 Teile Schwefel und 1 Teil Kohle) auf die Bildung von schwefeligsaurem bzw. kohlensaueren Gas hinwirkten, die dem Fortbrennen entzündeter Gegenstände hinderlich sind. Diese Dosen wurden entweder in den betreffenden Lokalen aufbewahrt und wirkten dann bei Entstehung eines Brandes nach ihrer Entzündung selbsttätig, oder es wurden dieselben zur Zeit des Brandes in die Lokale hineingeworfen, letztere aber wieder geschlossen (Morgenstern Karl: Über Einrichtungen und Schutzvorkehrungen zur Sicherung gegen Gefahren für Leben und Gesundheit der in gewerblichen Etablissements beschäftigten Arbeiter, Band 1: Allgemeines. A, Einrichtung der Arbeitsräume … B, Dampfkessel, … C, Motoren, … D, Transmissionen, Leipzig 1883, Seite 29).
Über die Erfahrungen mit diesem noch primitiven Löschmittel berichten die "Innsbrucker Nachrichten" vom 19. Dezember 1856:
- „ Am 13. d. M. wurde in Würzburg die angekündigte Probe mit den Bucher´schen Feuerlöschdosen gemacht. In einer Messbude war Reisig etc. angehäuft; dies wurde in Brand gesteckt, und als alles tüchtig brannte und das Feuer schon zum Dach der Bude herausschlug, wurden nacheinander drei Dosen; jede 5 Pfund, hineingeworfen. Alsbald drang aus den Rissen und Öffnungen der Bude dichter Qualm, welcher das Feuer zwar auf einige Sekunden dämpfte, es aber nicht vollkommen zu ersticken vermochte, worauf es mit erneuter Kraft fortbrannte und zuletzt durch eine Spritze gelöscht wurde. Trotz dieses ungenügenden Erfolges dürfte sich doch aus dieser Probe noch kein sicheres Urteil über die Tauglichkeit jenes Feuerlöschmittels bilden lassen; denn die Bude hatte nicht nur verschiedene Öffnungen, sondern es erweiterten sich auch, als durch die Hitze die Bretter zu schwinden begannen, alle Fugen derselben, sodass im Inneren ein starker Zug entstehen musste, während doch jenes Löschmittel zunächst nur auf geschlossene Räume berechnet ist. Zudem war, als man das Wasser anwandte, die letzte Dose noch nicht geplatzt. Soviel hat aber die gestrige Probe jedenfalls gezeigt, dass bei einem ordentlichen Brand gute Spritzen und eine tüchtige Löschmannschaft auch in Zukunft nicht zu entbehren sind. […] “
Einzelnachweise
Wikimedia Foundation.