- Flughafenmalaria
-
Klassifikation nach ICD-10 B50 Malaria tropica durch Plasmodium falciparum B51 Malaria tertiana durch Plasmodium vivax B52 Malaria quartana durch Plasmodium malariae B53 Sonstige parasitologisch bestätigte Malaria B54 Malaria, nicht näher bezeichnet ICD-10 online (WHO-Version 2006) Malaria (aus dem italienischen mala aria oder mal'aria „schlechte Luft“, die insbesondere aus den Sümpfen steigt) – auch Sumpffieber oder Wechselfieber genannt – ist eine meldepflichtige Tropenkrankheit, die von einzelligen Parasiten der Gattung Plasmodium hervorgerufen wird. Die Krankheit wird in den Tropen und Subtropen durch den Stich einer weiblichen Stechmücke (Moskito) der Gattung Anopheles übertragen. Außerhalb dieser Gebiete lösen gelegentlich durch Flugreisende eingeschleppte Moskitos die sogenannte „Flughafen-Malaria“ aus. Hierbei sind alle Personen im direkten Umfeld von Flughäfen gefährdet, z. B. Flughafenbedienstete oder Anwohner. Bis auf eine Übertragung durch Bluttransfusion und Laborunfälle ist eine Mensch-zu-Mensch-Ansteckung nur gelegentlich von der Mutter auf das ungeborene Kind möglich, wenn die Plazenta (besonders während der Geburt) verletzt wird. Der Mensch und die Anopheles-Mücken stellen das einzige nennenswerte Erregerreservoir humanpathogener Plasmodien dar.
Bislang galten nur vier Erreger als humanpathogen: Plasmodium falciparum, Plasmodium vivax, Plasmodium ovale und Plasmodium malariae. Neueste Forschungsergebnisse deuten jedoch darauf hin, dass ein weiterer Stamm, der bislang hauptsächlich als für Affen gefährlich galt, auch in größerer Zahl als bislang angenommen den Menschen infizieren kann: Plasmodium knowlesi [1] Hinsichtlich ihres Krankheitsverlaufes und ihrer geographischen Verbreitung unterscheiden sie sich erheblich. Plasmodium falciparum ist der klinisch bedeutsamste und bedrohlichste Erreger.
Die Symptome der Malaria sind hohes, wiederkehrendes bis periodisches Fieber, Schüttelfrost, Beschwerden des Magen-Darm-Trakts und Krämpfe. Besonders bei Kindern kann die Krankheit rasch zu Koma und Tod führen.
Inhaltsverzeichnis
Epidemiologie
Geographische Verteilung
Die geographische Verteilung (siehe Karte) gleicht der Verteilung der als Vektor geeigneten Anophelesarten, wobei zu beachten ist, dass das Vorkommen der Anopheles-Mücke auf niedrige Meereshöhen begrenzt ist, das heißt unter 2500 m am Äquator und unter 1500 m in den restlichen Gebieten der Erde. Durch die zunehmende Klimaerwärmung deutet sich mit der polwärtsgerichteten Ausbreitung der Überträgermücken eine weitere geographische Ausbreitung der Malaria an. Das Risiko in den einzelnen Endemiegebieten ist sehr unterschiedlich, was unter anderem saisonale und geographische Gründe hat. Im subsaharischen Afrika überwiegt Plasmodium falciparum deutlich vor allen anderen Plasmodienarten.
Auffallend ist, dass in Malariagebieten die Sichelzellenanämie, eine genetische Erkrankung mit charakteristischer Deformation der roten Blutkörperchen (sichelförmig), relativ häufig vorkommt. Träger dieser Erbkrankheit besitzen eine angeborene Resistenz gegen Malaria und somit einen Evolutionsvorteil gegenüber Personen ohne entsprechender Genmutation, die eher an Malaria sterben. Der genaue Grund der Resistenz konnte bisher nicht zweifelsfrei dargelegt werden (siehe Malariaresistenz). Der Vorteil beschränkt sich jedoch nur auf heterozygote Träger der Mutation; homozygote Träger sterben vorzeitig an der Sichelzellenanämie. In Afrika gibt es Regionen, in denen fast ein Drittel der Bevölkerung heterozygot für dieses Merkmal ist. In den anderen Weltgegenden ist diese Mutation kaum existent, da hier dieser Selektionsvorteil aufgrund der fehlenden Malaria nicht gegeben ist.
Jährliche Opfer und Inzidenz
Nach Angaben des Robert-Koch-Instituts in Berlin sterben weltweit jährlich 1,5 bis 2,7 Millionen Menschen an Malaria, etwa die Hälfte von ihnen sind Kinder unter fünf Jahren. 90 % der Erkrankten leben auf dem afrikanischen Kontinent. Die Zahl der jährlichen Neuerkrankungen wird auf 300 bis 500 Millionen Fälle geschätzt.
In Deutschland werden jährlich ca. 900 Erkrankte gemeldet, von denen 3–8 sterben (0,3–0,9 %). Der Großteil der Patienten ist in afrikanischen Endemiegebieten unterwegs gewesen (ca. 87 %).
Jahr 1980 1981 1982 1983 1984 1985 1996 1998 1999 2000 2001 2002 2003 2004 2005 2006 Gemeldete Fälle
in Deutschland*573 393 514 447 481 530 > 1.000 1.008 931 800 1.049 860 820 708 628 568 - * vor 1990 nur für die BRD und Westberlin
Quelle [2], Datenstand: 1. August 2007
Erreger
Liste humanpathogener Erreger
Plasmodium Inkubationszeit Malariaform Teilungsdauer/Fieberanfälle P. falciparum 7–30 Tage (90 %)
länger (10 %)*Malaria tropica unregelmäßig P. malariae 16–50 Tage Malaria quartana 72 Stunden P. ovale 12–18 Tage
länger (10 %)*Malaria tertiana 48 Stunden P. vivax 12–18 Tage
länger (10 %)*Malaria tertiana 48 Stunden (* bei unzureichender Malariaprophylaxe) Für den Menschen gefährlich sind die Erreger Plasmodium falciparum, Plasmodium vivax, Plasmodium ovale, Plasmodium malariae und Plasmodium knowlesi, die verschiedene Formen der Malaria auslösen können.
Darüber hinaus kann auch Plasmodium semiovale Malaria auslösen. Bei Mehrfachinfektionen mit gleichen oder verschiedenen Plasmodien können die Fieberanfälle auch unregelmäßig sein. Das sonst typische Wechselfieber bleibt aus, es herrscht konstantes Fieber.
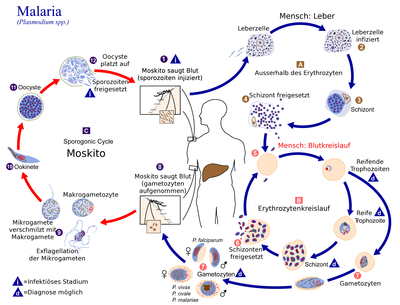
Lebenszyklus
Im Laufe ihres Lebenszyklus vollziehen die Erreger der Malaria, die Plasmodien, einen Wirtswechsel. Der Mensch dient dabei als Zwischenwirt. Als Endwirt dienen Stechmücken, insbesondere der Gattung Anopheles. In ihnen findet die Vermehrung der Plasmodien statt.
Im Menschen (asexuelle Phase / Schizogonie)
Nachdem der Mensch von einer infizierten Anopheles-Mücke gestochen wurde, sondert sie mit ihrem Speichel, welcher Gerinnungshemmer enthält, ca 10–15 Sporozoiten ab. Diese werden mit dem Blutstrom zur Leber getragen, wo sie in die Zellen des Lebergewebes eindringen und darin zum Leberschizont heranreifen. Dort findet eine Vermehrung (Teilung) statt, die exoerythrozytäre Schizogonie genannt wird. Dadurch entstehen bis zu 30.000 Merozoiten. Der Schizont platzt, und die Merozoiten gelangen in die Blutbahn. Bei Plasmodium vivax und Plasmodium ovale verbleiben Hypnozoiten ungeteilt im Lebergewebe. In diesem Ruhezustand können sie über Monate bis Jahre verbleiben. Durch einen unbekannten Stimulus reifen sie zu Schizonten heran, was zu charakteristischen Rückfällen der Malaria tertiana führt.
Die Merozoiten gehen in den Blutkreislauf über und befallen sodann rote Blutkörperchen. Sie dringen in diese ein und verwandeln sich dort in Ringformen, die zu einem Trophozoit heranreifen. Dieser verwandelt sich wiederum in einen Schizonten und kann im Durchschnitt acht bis zwölf Merozoiten freisetzen; bei Plasmodium falciparum sogar bis zu 32. Eine geringe Zahl von Merozoiten entwickeln sich zu Geschlechtsformen, Gametozyten. Diese befinden sich nach meist einer Woche in geringer Anzahl im Blut, weshalb sie in der Routinediagnostik kaum entdeckt werden. Die männlichen Gametozyten werden Mikrogametozyten und die weiblichen Makrogametozyten genannt.
In der Mücke (sexuelle Phase / Sporogonie)
Beim erneuten Stich einer Mücke werden die Gametozyten in die Mücke aufgenommen. Sie entwickeln sich in ihrem Darm zu Gameten. Der Mikrogamet penetriert den Makrogameten, und es entsteht eine Zygote. Diese verändert sich, nimmt eine längliche Form an und wird motil (= beweglich), diese Zelle heißt nun Ookinet. Er lagert sich zwischen den Gewebeschichten des Mückendarms an und verwandelt sich dort zur Oozyste. In ihr entstehen bis zu 1.000 neue Sporozoiten. Nach ihrer Freisetzung wandern sie in die Speicheldrüsen der Mücke und stehen nun zur Neuinfektion bereit. Der Zyklus in der Anopheles dauert abhängig von der Außentemperatur zwischen 8–16 Tagen. Dabei ist eine Mindesttemperatur von 15 °C erforderlich. Unterhalb dieser Temperatur kommt kein Zyklus mehr zustande.
Pathogenese
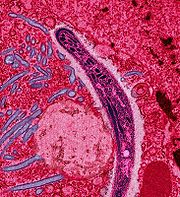 Plasmodium im Zytoplasma einer befallenen Zelle (EM-Aufnahme in Falschfarben)
Plasmodium im Zytoplasma einer befallenen Zelle (EM-Aufnahme in Falschfarben)Die mit Plasmodien infizierten, reifenden und platzenden roten Blutkörperchen setzen mit den Merozoiten Toxine (z. B. Phospholipide) frei, welche wiederum zur Freisetzung von Zytokinen führen. Die Zytokine sind hauptsächlich für den Fieberanstieg und einer beobachteten Absenkung des Blutzuckerspiegels (Hypoglykämie) verantwortlich. Die mit einer Laktatazidose verbundene Hypoglykämie wird nicht nur durch die Wirkung der Zytokine hervorgerufen, sondern ist auch eine Folge des Stoffwechsels der Parasiten. Ebenso kommt es bei hoher Parasitenanzahl im Blut durch Auflösung (Lyse) der roten Blutkörperchen, Abbau von befallenen roten Blutkörperchen in der Milz und Dämpfung der Erythropoese im Knochenmark durch die Zytokinfreisetzung (insbesondere durch den Tumornekrosefaktor-Alpha) zu einer Anämie.
Darüber hinaus bestehen zwischen Plasmodium falciparum und den anderen Malariaerregern wichtige pathogenetische Unterschiede.
Plasmodium falciparum
In den roten Blutkörperchen produziert der Trophozoit Proteine, wie zum Beispiel PfEMP1 (Plasmodium falciparum infected erythrocyte membrane protein 1), welches eine Bindung der infizierten Blutkörperchen an das Endothel der Blutgefäße bewirkt. Die damit verbundenen Mikrozirkulationsstörungen erklären zumindest teilweise den deutlich schwereren Verlauf der durch Plasmodium falciparum hervorgerufenen Malaria tropica.
Die Anhaftung der roten Blutkörperchen am Endothel und die mangelnde Verformbarkeit der befallenen Zellen, führt zu einer Verlegung der Kapillaren und somit zu einer Störung der Sauerstoff- und Nährstoffversorgung der Umgebung. Dies hat im zentralen Nervensystem besonders dramatische Auswirkungen und die häufigen zentralen Komplikationen der Malaria tropica zur Folge. Besonders kleine Kinder können in ein lebensbedrohliches Koma verfallen (cerebrale Malaria).
Übrige Plasmodien
Die übrigen Plasmodienarten sind nicht in der Lage am Endothel zu haften, womit auch die geringere Anzahl an Durchblutungsstörungen und somit die geringe Gefährlichkeit zu erklären ist. Plasmodium malariae unterscheidet sich von den anderen humanpathogenen Plasmodien dadurch, dass es vereinzelt auch andere höhere Primaten befällt.
Klinik
Aufgrund des unterschiedlichen Verlaufs der Erkrankung kann zwischen der Malaria tropica, der Malaria tertiana und der Malaria quartana unterschieden werden. Die Malaria tropica ist dabei die schwerste Verlaufsform der Malaria.
Malaria tropica
Die Malaria tropica wird durch den Erreger Plasmodium falciparum verursacht. Charakteristisch für die Malaria tropica sind die hohe Parasitämie, die teils ausgeprägte Anämie und die häufig vorkommenden neurologischen Komplikationen. Es kann ein rhythmischer Fieberverlauf vorliegen. Ein Fehlen der Fieberrhythmik ist jedoch kein Ausschlusskriterium einer Malaria tropica.
Inkubationszeit
Zwischen dem Stich der Anopheles-Mücke und dem Krankheitsausbruch liegen im Mittel zwölf Tage. Erheblich kürzere Zeitintervalle treten bei einer Infektion mit erregerhaltigem Blut auf. Längere Inkubationszeiten sind unter Einnahme einer unzureichenden Chemoprophylaxe möglich.
Fieber
Das typische wechselnde Fieber mit Schüttelfrost beim Fieberanstieg und Schweißausbrüchen bei Entfieberung, wie es bei anderen Malariaformen auftritt, wird bei der Malaria tropica in der Regel nicht beobachtet. Daher kann man eine Malaria, eine Malaria tropica insbesondere, nicht allein aufgrund der Tatsache ausschließen, dass keine typische Fieberrhythmik vorliegt. Ein hohes Fieber über 39,5 °C tritt häufig bei Kindern auf und ist als prognostisch ungünstig zu beurteilen. Häufig kommt es zu zentralen Komplikationen und Koma.
Neurologische Komplikationen
Bewusstseinsstörungen, die bis zum Koma reichen können, stellen eine typische Komplikation der Malaria tropica dar. Dabei sind plötzliche Wechsel der Bewusstseinslage ohne Vorzeichen durchaus möglich. Es kann auch zu einer langsamen Eintrübung des Patienten kommen. Im Rahmen einer zerebralen Malaria können auch neurologische Herdsymptome wie Lähmungen und Krampfanfälle auftreten. Die normale neurologische Diagnostik führt hier kaum zu einer adäquaten Diagnose. Eine hohe Parasitenzahl im Blut dient als entscheidender Hinweis.
Bei Schwangeren und Kindern können Hypoglykämien auftreten, die allein oder mit der zentralen Problematik zum Koma führen.
Anämie
Anämien treten häufig bei schweren Infektionen auf. Eine besondere Risikogruppe für schwere Anämien stellen Säuglinge und Kleinkinder dar. Meist handelt es sich um eine hämolytische Anämie durch Zerstörung roter Blutkörperchen. Wie oben erwähnt besitzt auch die Hemmung der Erythropoese eine gewisse Bedeutung. Die Schwere der Anämie korreliert stark mit dem Ausmaß des Parasitenbefalls.
Hämoglobinurie
Der durch die massive Hämolyse angestiegene Hämoglobin-Spiegel im Blut führt zu einer Hämoglobinurie (daher die frühere Bezeichnung Schwarzwasserfieber), dem Ausscheiden von Hämoglobin über die Nieren. Diese Hämoglobinurie kann zu einem akuten Nierenversagen führen.
Veränderungen anderer Organsysteme
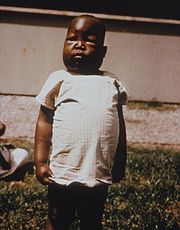 Kind mit massiven Ödemen (Anasarka) aufgrund malariabedingter Niereninsuffizienz
Kind mit massiven Ödemen (Anasarka) aufgrund malariabedingter NiereninsuffizienzIm Laufe der Erkrankung kann es zu einer Vergrößerung der Milz (Splenomegalie) kommen, bedingt durch die große Zahl dort abzubauender Trümmer roter Blutkörperchen. In seltenen Fällen führt das Gewebswachstum zu einer Spannung der Kapsel, so dass diese leicht einreißen kann (Milzruptur). Den Magen-Darm-Trakt betreffende Symptome wie Durchfälle sind häufig und differentialdiagnostisch von Bedeutung, da sie bei fehlendem oder schwach ausgeprägtem Fieber zur falschen Diagnose bakterielle Enteritis führen können.
In bis zu zehn Prozent der Fälle kann eine Lungenbeteiligung auftreten, die von leichten Symptomen bis zu einem Lungenödem reichen kann.
Nicht selten kommt es durch eine Durchblutungsstörung der Niere zu einem akuten Nierenversagen. Nach ausgeheilter Infektion erholt sich die Niere meist.
Malaria tertiana
Die Malaria tertiana wird durch die Erreger Plasmodium vivax oder Plasmodium ovale verursacht. Sie ist eine der gutartigen Verlaufsformen der Malariaerkrankung. Es treten im Vergleich zur Malaria tropica kaum Komplikationen auf. Das Hauptproblem besteht darin, die unspezifischen Vorsymptome von der bösartigen Malaria tropica abzugrenzen. Dies gelingt meist nur in der mikroskopischen Diagnostik.
Inkubationszeit
Die Inkubationszeit beträgt zwischen 12 und 18 Tagen, kann aber auch mehrere Monate dauern, wenn der Verlauf der Infektion durch die Chemoprophylaxe verlangsamt wird.
Fieber
Nach einer unspezifischen Prodromalphase von wenigen Tagen stellt sich normalerweise die typische Dreitagesrhythmik ein, die der Malaria tertiana ihren Namen gab. Zwischen zwei Fieberanfällen liegen in der Regel zwei fieberfreie Tage.
Die Fieberattacken gehorchen meist folgendem Schema:
- Froststadium (1 Stunde): Der Patient leidet unter Schüttelfrost und dem subjektivem Gefühl starker Kälte. In dieser Phase steigt die Temperatur steil an.
- Hitzestadium (4 Stunden): Die Haut brennt häufig quälend. Es treten schwere Übelkeit, Erbrechen und Mattigkeit auf. Die Temperatur kann über 40 °C betragen, die Haut ist im Gegensatz zum nächsten Stadium meist trocken.
- Schweißstadium (3 Stunden): Unter starkem Schwitzen sinkt die Temperatur bis zum Normalwert von 37 °C, Nachlassen der Mattigkeit noch vor Entfieberung.
Wie bei allen anderen Malariaformen gilt auch hier, dass das Fehlen der Fieberrhythmik keineswegs ausreicht, um die Krankheit auszuschließen.
Malaria quartana
Die Malaria quartana wird durch den Erreger Plasmodium malariae verursacht. Auch hier handelt es sich um eine gutartige Form der Malaria. Eine charakteristische Komplikation ist das nephrotische Syndrom. Besonders an dieser Form ist, dass es selbst nach einer sehr langen Zeit (> 50 Jahre) noch zu Rezidiven kommen kann. Auch ist die Inkubationszeit erheblich länger als bei den beiden anderen Formen.
Inkubationszeit
Die Inkubationszeit beträgt zwischen 16 und 50 Tagen. Somit ist sie erheblich länger als bei den übrigen Krankheitsformen.
Fieber
Die Prodromalphase ist genauso unspezifisch wie die der Malaria tertiana. Schon nach wenigen Tagen stellt sich die Vier-Tages-Rhythmik ein. Zwischen zwei Fiebertagen liegen zwei fieberfreie Tage. Die Stadienabfolge (Frost-Hitze-Schweiß) am Fiebertag entspricht der Malaria tertiana. Auch hier gilt: fehlende Fieberrhythmik schließt die Diagnose Malaria nicht aus.
Nierenbeteiligung
Im Verlauf der Malaria quartana kann es zu einer schweren Nierenbeteiligung kommen. Diese wird unter anderem als Malarianephrose bezeichnet. Es handelt sich hierbei um ein nephrotisches Syndrom mit folgenden Symptomen:
- niedriges Serumeiweiß Albumin (im Blutkreislauf mitverantwortlich für die Regulation des Wasserhaushalts)
- Wasseransammlung im Bindegewebe (Ödeme) und der Bauchhöhle (Aszites) durch den Albuminmangel
- erhöhtes Serumcholesterin
Epidemiologische Studien haben gezeigt, dass diese Komplikation gehäuft bei Kindern zwischen zwei und zehn Jahren im tropischen Afrika auftritt.
Rezidive
Wie schon oben erwähnt, bilden sich im Lebenszyklus von Plasmodium vivax und Plasmodium ovale Ruheformen, die sogenannten Hypnozoiten, aus. Sie können der Anlass dafür sein, dass es nach einer Ruhephase von Monaten bis Jahren zum erneuten Ausbruch der Krankheit kommt. Diesem muss nicht unbedingt eine anamnestisch bekannte Malariaerkrankung vorausgehen. Die Rezidive sind besonders tückisch, da oft weder vom Patient noch vom Arzt ein Zusammenhang zur Malaria hergestellt wird. Das besondere an diesem Plasmodium sind die Rezidive nach besonders langem krankheitsfreiem Intervall (mehrere Jahre). Rezidive nach Krankheitsfreiheit von mehr als 50 Jahren wurden beschrieben. Die Rezidive kommen aber hier nicht durch Hypnozoiten in der Leber zustande (es gibt keine Hypnozoitformen des Plasmodium malariae), sondern durch einen fortdauernden Parasitenbefall des Blutes. Dieser ist so gering, dass er mikroskopisch meist nicht nachgewiesen werden kann. Dies ist besonders in der Transfusionsmedizin in Endemiegebieten von großer klinischer Bedeutung, da es auch bei negativ getestetem Spender zu einer Malariaübertragung kommen kann, wenn Frischblut eingesetzt wird. Blutkonserven werden hingegen gekühlt gelagert, was Malaria-Erreger abtötet.[3] Rezidive können jedoch in der Regel durch medikamentöse Maßnahmen (in erster Linie unter Einsatz von Primaquin) langfristig unterbunden werden.
Diagnostik
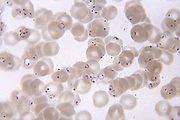
Die Diagnose Malaria sollte mit Hilfe labordiagnostischer Methoden abgesichert werden. Die in der Praxis wichtigste und kostengünstigste Methode bei Malariaverdacht ist die mikroskopische Untersuchung von normalen Blutausstrichen (Dünner Tropfen) und dem bis zu 10-fach angereicherten Dicken Tropfen unter Verwendung der Giemsa-Färbung auf Plasmodien. Eine Differenzierung der vier Plasmodien ist anhand morphologischer Kriterien möglich (siehe Maurersche Fleckung oder Schüffnerschen Tüpfelung). Die ermittelte Parasiten- und Leukozytenzahl ist ein Maß der Schwere der Erkrankung. Ein negatives Ergebnis der mikroskopischen Untersuchung kann aufgrund der geringen Sensitivität dieser Methode eine Malaria jedoch nicht ausschließen.
Alternativ können die Erreger der Malaria immunologisch und molekularbiologisch nachgewiesen werden. Die zur Verfügung stehenden Malaria-Schnelltests (z. B. ICT Malaria P.F.®-Test, OptiMal®-Test) beruhen auf Nachweis parasitenspezifischer Antigene. Ein negatives Ergebnis kann jedoch auch bei diesen Tests eine Malaria nicht ausschließen. Das mit Abstand sensitivste Verfahren für die Malaria-Diagnostik ist die Polymerasekettenreaktion (PCR). Sie ist jedoch aufgrund des hohen Material- und Zeitaufwands für den Akutfall wenig geeignet.
Vorbeugung und Behandlung
Da kein hundertprozentiger Schutz gegen Malaria besteht (fehlender Impfschutz gegen Malaria), sollte das Risiko einer Malariaerkrankung gesenkt werden. Der wirksamste Schutz ist der Verzicht auf Reisen in Gebiete, in denen Malaria übertragen wird (Endemiegebiete). Da dies nicht immer möglich ist, ist die Vermeidung von Insektenstichen (Expositionsprophylaxe) das wichtigste Element der Malariavorbeugung. Zusätzlich sollte durch vorbeugende Einnahme (Chemoprophylaxe) oder Mitführen (Stand-By-Therapie) von Malaria-Medikamenten das Risiko verringert werden, an einer schweren Malaria zu erkranken.[4]
Unabhängig davon, ob eine Chemoprophylaxe oder eine Stand-by-Therapie gewählt wurde, muss bei jedem unklaren Fieber in den Tropen und auch lange Zeit nach der Rückkehr umgehend ein Arzt aufgesucht werden. Dieser sollte mittels eines geeigneten Bluttests den Malariaverdacht schnellstmöglich bestätigen oder ausschließen, da eine nicht rechtzeitig behandelte Malaria Tropica tödlich sein kann.
Impfung
Zur Zeit steht noch kein Impfstoff zu Verfügung. Auf diesem Gebiet wird zwar seit Jahren geforscht, mit der kurzfristigen Einführung eines wirksamen Impfstoffes ist trotz Hoffnung erweckender Forschungsergebnisse jedoch vorerst nicht zu rechnen.
Insektenschutz
Der Insektenschutz ist der wichtigste Bestandteil der Malariavorbeugung. Dazu zählt das Tragen heller, hautbedeckender, langer Kleidung, der Aufenthalt in mückensicheren Räumen (insbesondere nachts; Klimaanlage, Fliegengitter, Moskitonetz) sowie die Behandlung von Haut und Kleidung mit moskitoabweisenden Mitteln, sog. Repellents (z. B. Icaridin oder DEET). Die zusätzliche Verwendung von Insektiziden in Sprays (allen voran Pyrethroide), Verdampfern, Räucherspiralen („mosquito coils“) und ähnlichem kann zusätzlichen Schutz bieten. Nach wie vor schützen sich jedoch viele Reisende nicht konsequent gegen Mücken. So ergab eine im April 2006 veröffentlichte Untersuchung aus Frankreich, dass weniger als 10 % der an Malaria erkrankten Patienten Maßnahmen zur Abwehr von Insekten verwendet hatten.
Chemoprophylaxe und Therapie
Für viele Reiseziele reicht es aus, für den tatsächlichen Krankheitsfall ein Medikament zur notfallmäßigen Eigenbehandlung (Stand-by-Therapie) mitzuführen. Dennoch wird eine Chemoprophylaxe unter Beachtung möglicher Arzneimittelnebenwirkungen und unter Berücksichtigung der persönlichen Gesundheitssituation (Vorerkrankungen, Immunstatus, ...) bei Reisen in Malariagebiete mit hohem Infektionsrisiko häufig empfohlen.
Seit dem 17. Jahrhundert wird die Chinarinde und das daraus gewonnene Chinin zur Therapie der Malaria verwendet – die Legende besagt, dass britische Kolonialisten daher regelmäßig stark chininhaltiges Tonic Water tranken und, um den damals sehr bitteren Geschmack zu verbessern, oft dieses mit Gin mischten und so den Gin Tonic erfanden. Seit Mitte des 20. Jahrhunderts haben sich die Therapiemöglichkeiten vervielfacht, und es besteht die Möglichkeit einer medikamentösen Vorbeugung (Chemoprophylaxe). Das größte Problem bei der medikamentösen Vorbeugung und Behandlung ist eine zunehmende Resistenz des Erregers. Die Deutsche Gesellschaft für Tropenmedizin und Internationale Gesundheit e. V. empfiehlt derzeit (Stand 2007):
- in Gebieten mit hohem Malariarisiko und bekannter Chloroquin- und Mefloquin-Resistenz (z. B. Goldenes Dreieck): Aufenthalt > 7 Tage: Prophylaxe mit Atovaquon-Proguanil oder Doxycyclin. Aufenthalt < 7 Tage: keine Prophylaxe, bei Erkrankung Notfalltherapie mit Artemether-Lumefantrin oder Atovaquon-Proguanil.
- in Gebieten mit hohem Malariarisiko und bekannter Chloroquinresistenz (z. B. Hochrisikogebiete Afrikas, Papua-Neuguinea, Salomonen, Brasilien (Bundesstaaten Rondônia, Roraima und Amapá)): Prophylaxe mit Atovaquon-Proguanil, Doxycyclin oder Mefloquin. Die im Jahr 2003 erschienene Allmalpro-Studie konnte bei der Chemoprophylaxe eine bessere Verträglichkeit von Atovaquon-Proguanil und Doxycyclin im Vergleich zu Mefloquin belegen.
- in Gebieten mit geringem Malariarisiko und bekannter Chloroquin- und Mefloquinresistenz (z. B. Südost-Asien ohne Hochrisikogebiete): keine Prophylaxe, bei Erkrankung Notfalltherapie mit Artemether-Lumefantrin oder Atovaquon-Proguanil.
- in Gebieten mit geringem Malariarisiko und bekannter Chloroquinresistenz (z. B. Brasilien ohne Aufenthalt in den Hochrisikogebieten > 7 Tage, Volksrepublik China, Taiwan, Vanuatu, Arabische Halbinsel, Indien ohne Aufenthalt in Hochrisikogebieten > 7 Tage, Irak, Iran, Afghanistan, Pakistan, Bangladesch, Sri Lanka, Indonesien ohne Aufenthalt in Hochrisikogebieten > 7 Tage, Philippinen): keine Prophylaxe, bei Erkrankung Notfalltherapie mit Artemether-Lumefantrin, Atovaquon-Proguanil oder Mefloquin
- in Gebieten mit geringem Malariarisiko ohne bekannte Resistenzen (z. B. Mittelamerika, Haiti, Dominikanische Republik): keine Prophylaxe, bei Erkrankung Notfalltherapie mit Chloroquin
Des Weiteren stehen Chinin (zur Therapie, insbesondere bei der komplizierten Malaria tropica), Primaquin (Therapie der Malaria tertiana oder Malaria quartana; beugt Rezidiven vor; Verwendung zur Prophylaxe nur in Ausnahmefällen) und Proguanil (Prophylaxe; meist in Kombination mit Chloroquin; Verwendung nur noch in Ausnahmefällen) zur Verfügung. Vor allem in China, Südostasien und Afrika werden Artemisinin-haltige Präparate (einschließlich deren Abkömmlinge Artemether, Artesunat, Arteflene, Artemotil, Dihydroartemisinin und Arteether) eingesetzt. Diese im Rahmen einer Kombinationstherapie (Artemisinin-based combination therapy) eingesetzten Präparate werden von der WHO als Mittel der ersten Wahl für die Akutbehandlung der Malaria empfohlen. Artesunat wird seit neuestem auch von der AG Malaria der Paul-Ehrlich-Gesellschaft als Mittel der ersten Wahl zur Therapie der komplizierten Malaria tropica empfohlen. Die Stand-By-Therapeutika Halofantrin und Amodiaquin wurden in Europa wegen schwerer Nebenwirkungen mittlerweile vom Markt genommen, sind jedoch noch vereinzelt in Malariagebieten als Notfallmedikamente verfügbar. Halofantrin wurde mit Herzrhythmusstörungen in Verbindung gebracht, während unter der Therapie mit Amodiaquin vermehrt Leberschäden und Blutbildschäden (Agranulozytose, aplastische Anämie) auftraten. Insbesondere in Endemiegebieten ist die Kombination von Sulfadoxin-Pyrimethamin, die sowohl zur Therapie als auch zur Prophylaxe für einheimische schwangere Frauen in Endemiegebieten als „intermittent Preventive Treatment“ (IPT) angewendet wird, verfügbar. Diese Arzneistoffkombination wurde jedoch in Deutschland aufgrund schwerer Hautreaktionen (Stevens-Johnson-Syndrom) vom Markt genommen.
In jedem Falle ist es wichtig und sinnvoll sich rechtzeitig vor jeder Reise über die aktuelle Risiko- und Resistenzsituation zu informieren und mit einem tropenmedizinisch erfahrenen Arzt die persönliche Vorsorge zu planen.
Vektorkontrolle
Als Vektorkontrolle (Bekämpfung des Überträgers) bezeichnet man den Versuch, Neuinfektionen durch gezielte Bekämpfung der Anopheles-Mücke zu verhindern. Zu diesem Zweck werden Insektizide in den Wohnstätten der Menschen versprüht, oder es wird die Verwendung von insektizidimprägnierten Bettnetzen (IIB) propagiert.
In den 1950er und 1960er Jahren wurde unter Federführung der WHO versucht, die Malaria auszurotten. Ein wichtiger Bestandteil der Kampagne war das Besprühen der Innenwände aller Wohnungen und Häuser mit DDT. Nach anfänglichen Erfolgen wurde das Projekt Anfang der 1970er Jahre eingestellt, unter anderem weil durch die Selektion nur noch DDT-resistente Anopheles-Mücken überlebten und sich rasch vermehrten.
Der Einsatz von DDT in Wohnhäusern wird auch heute noch für vertretbar erachtet, da es dem Menschen sicher weniger schadet als eine Malaria-Infektion. Negative Auswirkungen auf die Umwelt sind wegen der im Vergleich zur Landwirtschaft geringen Aufwandmengen nicht zu befürchten. Vor einem Einsatz von DDT oder anderen Insektiziden sollte immer die Resistenzsituation der Anopheles-Mücken im betreffenden Gebiet geprüft werden. Heute ist die Herstellung und Verwendung von DDT weltweit nur noch zum Zwecke der Bekämpfung von Krankheitsüberträgern zugelassen.
Forschung
Die Basensequenzen in den Genomen von Plasmodium falciparum und Anopheles gambiae wurden im Herbst 2002 vollständig entschlüsselt. Etwa zeitgleich wurden neue Malariatherapeutika, wie z. B. Atovaquon, Lumefantrin und die vom Naturstoff Artemisinin abgeleiteten Artesunat und Artemether, auf den Markt gebracht. Erste Erfolg versprechende Ergebnisse der Behandlung Malariakranker mit Tafenoquin und dem Antibiotikum Fosmidomycin wurden ebenso vorgestellt. So blockiert beispielsweise Fosmidomycin den MEP-Weg, ein Stoffwechselweg zum Dimethylallylpyrophosphat (DMAPP). Dadurch können in der Folge wichtige, vom DMAPP ausgehende zelluläre Grundbausteine wie Zellwände und Zellanker nicht mehr synthetisiert werden.
Versuche, einen weltweit wirkenden Impfstoff gegen die Malaria zu entwickeln, schlugen trotz einiger anfänglicher Erfolge jedoch bisher fehl. Das größte Problem bei der Entwicklung eines wirksamen Impfstoffes ist die hohe Variabilität der Malaria-Antigene. Eine neue Hoffnung versprechen entschärfte lebende Erreger, denen das Gen UIS3 eliminiert wurde. Diese Sporozoiten wurden Mäusen gespritzt, wobei keinerlei Plasmodienformen entstanden, die von dem symptomlosen Leberstadium in die roten Blutkörperchen wechseln konnten. Das Ergebnis der Immunreaktion war eindrucksvoll. Keine einzige geimpfte Maus steckte sich nach einer Infektion mit normalen Plasmodien an, während in der Kontrollgruppe alle erkrankten.[5] Ein weiterer aussichtsreicher Kandidat ist RTS,S, der aus dem Hepatitis B Impfstoff Hepatitis-B-Virus (S) besteht, welcher zusätzlich das Oberflächenprotein der Plasmodium falciparum Sporozoiten (das Circumsporozoite Protein) trägt (RTS). Dadurch wird eine Immunantwort ausgelöst, die die Plasmodien in einem frühen Stadium, noch bevor sie die Leber infizieren, bekämpft. Zusätzlich wird ein Impfschutz gegen das Hepatitis B Virus induziert.[6] Für einen vollständigen Immunschutz ist geplant, den Impfstoff mit weiteren Antigenen des Malaria-Erregers zu kombinieren.[7] Ein interessanter alternativer Therapieansatz dürfte die Verwendung eines Antikörpers gegen Plasmodien sein. Ein weiterer Ansatz aktueller Forschung ist es, die Vermehrung der Plasmodien zu verhindern. Untersuchungen an Mäusen zeigten, dass es prinzipiell möglich ist, über einen Impfstoff die Verschmelzung weiblicher und männlicher Keimzellen des Plasmodium zu blockieren und somit die Weitergabe des Erregers einzudämmen.[8]
Eine weitere Möglichkeit der Bekämpfung der Malaria ist das Unterbrechen der Infektionskette durch Bekämpfen der Anopheles-Mücke. Ein entsprechender Versuch zur Ausrottung der Malaria mit Hilfe von DDT scheiterte in den 1960er Jahren. Mit Hilfe von Insektiziden konnten nur örtlich und zeitlich begrenzte Teilerfolge erreicht werden. Ein hoffnungsvoller neuer Ansatz ist der Einsatz des biogenen Insektizids Bti bestehend aus dem Bacillus thuringiensis israeliensis. Dieses biologische Präparat, das über Züchtung millionenfach im Labor hergestellt werden kann, ist gegenüber Stechmücken ein erprobtes, hochwirksames Präparat, das bei richtiger Anwendung „Nicht-Ziel-Organismen“ weitgehend schont. Bti wird in kristalliner Form in die aquatilen Lebensräume von Stechmücken ausgebracht. Die Anopheles-Larven nehmen die Bakterien bei der Nahrungsaufnahme in ihren Körper auf. Im Darm der Mücken schlüpfen die Bakterien aus ihrer schützenden Eiweißhülle und zerstören in kurzer Zeit durch die Bildung von Delta-Endotoxinen das Darmlumen und die Darmwände ihrer Wirtstiere. Die Stechmückenlarven stellen daraufhin ihre Nahrungsaufnahme ein und gehen noch im Larvalstadium zugrunde. Bti wird kommerziell angeboten. Das Insektizid ist in flüssiger, Tabletten-, Pulver- und in Granulatform erhältlich. Für den großflächigen Einsatz im Freiland hat sich die Verwendung von Granulat bewährt. Bei starker Durchseuchung der Gewässer wird die Ausbringung des Granulats durch Hubschrauber praktiziert.
Außerdem forscht die gemeinsame Abteilung der IAEO und FAO an einer neuartigen Methode zur Bekämpfung der Anopheles-Mücke. In diesem Zusammenhang wird die Aussetzung steriler oder genetisch modifizierter Anopheles-Mücken diskutiert (Sterile Insect Technology).
In Zusammenarbeit mit der WHO erarbeiten gegenwärtig das Kenya Medical Research Institute und die britische Universität Oxford im Internet verfügbare Weltkarten, auf denen das gesamte Wissen über die Verbreitung der Malaria zusammengetragen wird (z. B. Infektionsrate Plasmodium falciparum, Plasmodium vivax). Dieses Malaria Atlas Projekt genannte Unterfangen wird vom englischen Wellcome Trust finanziert und ständig erweitert.[9]
Armutsbedingte Krankheit
Die Malaria wird auch als armutsbedingte Krankheit bezeichnet. Hinter dieser Bezeichnung steht das Kalkül, dass von der Krankheit hauptsächlich arme Menschen betroffen sind, die über wenig Kaufkraft verfügen und folglich keinen attraktiven Markt bilden. Für Pharmaunternehmen ist es daher ökonomisch sinnvoller, Mittel gegen medizinisch weniger „dringende“ Krankheiten zu erforschen, deren Betroffene kaufkräftiger sind.
Norbert Blüm schreibt dazu in der Süddeutschen Zeitung vom 7. Oktober 2003:
„Die Pharmaindustrie gibt weltweit doppelt so viel Forschungsmittel im Kampf gegen Haarausfall und Erektionsschwächen aus wie gegen Malaria, Gelbfieber und Bilharziose. Das ist marktwirtschaftlich konsequent, denn die Kunden mit Erektionsschwächen und Haarausfall haben in der Regel mehr Kaufkraft als die Malaria- und Gelbfieberkranken.“[10]
Die Europäische Union will als Reaktion auf diesen Mechanismus die Entwicklung von Mitteln gegen armutsbedingte Krankheiten mit 600 Millionen Euro fördern.[11]
Andererseits ist es fraglich, ob gerade für Regionen, in denen die Malaria wie die Armut verbreitet sind, die Bekämpfung der Malaria durch Entwicklung eines Impfstoffes im Vordergrund stehen sollte. Der Parasitologe Paul Prociv weist darauf hin, dass Erwachsene in Malariagebieten durch ständige Reinfektion praktisch immun gegen die Krankheit sind. Vorrang hätte die Hebung der allgemeinen Gesundheitsfürsorge und Lebensumstände. Von einem Malariaimpfstoff würden hauptsächlich westliche Besucher der Tropen profitieren, die die Nebenwirkungen der herkömmlichen Malariavorsorge scheuen.[12]
Aufgrund der mangelnden finanziellen Unterstützung gab Bill Gates Ende Oktober 2005 bekannt, dass er zur Förderung der Malariaforschung eine Summe von 258,3 Millionen Dollar zur Verfügung stellen werde. Seiner Meinung nach stelle „es für die Welt eine Schande dar, dass sich in den letzten 20 Jahren jene durch Malaria hervorgerufenen Todesfälle verdoppelten, zumal gegen jene Krankheit sehr stark vorgegangen werden könnte.“[13]
Volkswirtschaftliche Auswirkung
Nach Jeffrey Sachs sind tropische Krankheiten, insbesondere aber Malaria, eine Hauptursache für die wirtschaftliche Misere der ärmsten Länder der Erde: Wo diese Krankheit auftritt, also vor allem in den Tropen und Subtropen, herrscht auch Armut. So hatten Mitte der 1990er-Jahre von Malaria heimgesuchte Länder ein durchschnittliches Volkseinkommen von rund 1.500 Dollar pro Kopf, während nicht betroffene Länder mit durchschnittlich 8.200 Dollar über mehr als das Fünffache verfügten. Volkswirtschaften mit Malaria sind zwischen 1965 und 1990 durchschnittlich nur um 0,4 Prozent im Jahr gewachsen, die anderen dagegen um 2,3 Prozent[14]. Der durch die Krankheit verursachte volkswirtschaftliche Schaden für Afrika allein wird umgerechnet auf rund 9,54 Milliarden Euro pro Jahr geschätzt.
Nach Studien liegt die durch Malaria verursachte Lähmung der Volkswirtschaften der betroffenen Länder nicht nur an den direkten Kosten für Medikamente und medizinische Behandlung. Malaria hat eine negative Auswirkung auf die Arbeitsproduktivität und somit auf das Bruttoinlandsprodukt des Landes, womit nötige Investitionen, wie beispielsweise in Bildung, ausbleiben. Zudem meiden ausländische Investoren solche Länder ebenso wie Touristen und Handelsunternehmen[15].
Mittlerweile hat AIDS die ungünstige Situation für diese Länder noch dramatisch verschlimmert.
Geschichte
Die frühesten Berichte von Malariaepidemien sind uns von den Alten Ägyptern (u.a. aus dem Papyrus Ebers) erhalten. Die ältesten DNA-Funde wurden neuerdings dann auch von Münchener Pathologen um Andreas Nerlich in zwei ägyptischen Mumien aus Theben gefunden, die ca. 3500 Jahre alt sind[16]. Aber auch in rund 3000 Jahre alten indischen Schriften taucht das Wechselfieber auf. Die Chinesen hatten vor über 2000 Jahren sogar schon ein Gegenmittel. Sie nutzten die Pflanze Qinghao, ein Beifuß-Gewächs. In der Neuzeit konnten Forscher tatsächlich einen wirksamen Stoff aus dieser Pflanze isolieren: das Artemisinin.
In der Antike verbreitete sich die Malaria rund um das Mittelmeer. Hippokrates erkannte, dass Menschen aus Sumpfgebieten besonders häufig betroffen waren, jedoch vermutete er, dass das Trinken von abgestandenem Sumpfwasser die Körpersäfte (vgl. Humoralpathologie) in ein Ungleichgewicht bringt. Von unsichtbaren Krankheitserregern wusste man damals noch nichts.
Auch das Römische Reich wurde regelmäßig von schweren Malariaepidemien heimgesucht. Einige Historiker gehen sogar davon aus, dass sie einen der entscheidenden Faktoren für den Untergang des Römischen Reiches darstellen. Erst unlängst wurde bei Rom ein Kindermassengrab mit über 50 Leichen entdeckt, das auf das Jahr 50 datiert wurde. Aus den Knochenresten dieser Kinderskelette konnte die DNA von Plasmodium falciparum isoliert werden.
Im Mittelalter bis zur Mitte des 20. Jahrhunderts war die Malaria nicht nur in Süd-, sondern auch in Mitteleuropa verbreitet. Zum Beispiel war es in Norddeutschland als Marschenfieber bekannt. Berühmte europäische Malariapatienten waren Friedrich Schiller und Oliver Cromwell. Erst durch die Trockenlegung von Sumpfgebieten und durch den systematischen Einsatz von Insektiziden konnte die Malaria in den 1960er Jahren in Europa ausgerottet werden.
Aus Nord- und Südamerika sind die ersten Malariafälle erst im 16. Jahrhundert dokumentiert. Man geht heute davon aus, dass sie durch die Europäer bzw. durch den von ihnen organisierten Sklavenhandel dort eingeschleppt worden ist. Doch ausgerechnet von dort kam ein Heilmittel, das heute noch Verwendung findet. Peruanische Arbeiter bekämpften Fieber erfolgreich mit der Rinde eines Baumes aus der Familie der Rötegewächse, zu denen auch die Kaffeepflanze gehört. Mitglieder des Jesuitenordens beobachteten diese Wirkung und brachten das Mittel in Pulverform erstmals 1640 nach Europa, wo es auch „Jesuitenpulver“ genannt wurde. Der Baum wurde später als „Chinarinde“ (Cinchonia) bekannt, das Medikament als „Chinin“.
Chinin hat einen äußerst bitteren Geschmack und ist hellbraun bis beige. Es wird als Aromastoff für Tonicwater und Bitter Lemon verwendet. Bis heute hält sich die Legende, regelmäßiges Trinken von Gin Tonic schütze vor Malaria. Jedoch ist heutzutage die Chininkonzentration in einem Gin-Tonic-Drink viel zu gering.
Der Malariaerreger wurde am 6. November 1880 vom Franzosen Alphonse Laveran entdeckt, der in Constantine (Algerien) am Militärkrankenhaus arbeitete. Er erhielt dafür 1907 den Nobelpreis für Medizin.
Ronald Ross, Chirurg und General aus England, fand 17 Jahre später bei seiner Arbeit während des Baus des Sueskanals den Zusammenhang zwischen dem Malariaerreger und dem Stich der Anophelesmücke heraus und erhielt dafür nicht ganz unumstritten den Nobelpreis für Medizin 1902. Den Zusammenhang zwischen Mücken und Malaria hatten im übrigen schon die alten Ägypter 3000 v. Ch. erkannt. Sie wurde als Fluch der Götter bzw. des Nils angesehen.
Julius Wagner-Jauregg infizierte 1917 einige seiner Patienten gezielt mit Malaria, um mit den auftretenden Fieberschüben die progressive Paralyse zu behandeln. Diese sogenannte Malariatherapie erwies sich als erfolgreich und wurde bis zum Aufkommen von Antibiotika praktiziert, 1927 erhielt Wagner-Jauregg dafür den Medizin-Nobelpreis. Wegen der damit verbundenen Risiken gilt der Einsatz von Malaria als Therapeutikum heute jedoch als nicht mehr vertretbar.
In den 1950er-Jahren begann die WHO das Global Eradication of Malaria Program. Neuansteckungen durch Mückenstiche sollten durch Besprühen der Innenwände der Häuser mit DDT-Lösung verhindert werden. Parallel dazu sollten die bereits Erkrankten mit Chloroquin behandelt werden, um auch die eigentlichen Erreger, die Plasmodien, zu bekämpfen.
Die Kampagne war nur teilweise erfolgreich. In Holland, Italien, Polen, Ungarn, Portugal, Spanien, Bulgarien, Rumänien und Jugoslawien wurde Malaria bis Ende der 1960er Jahre dauerhaft ausgerottet. Auch in vielen Ländern Asiens sowie Süd- und Mittelamerikas konnte die Zahl der Neuansteckungen mit Malaria drastisch gesenkt werden. Hier wurden häufig nach ersten Erfolgen Geld und medizinisches Personal aus den Anti-Malaria-Kampagnen abgezogen und anderweitig eingesetzt. Dadurch blieben neue Malariafälle unentdeckt oder konnten nicht ausreichend behandelt werden. Im Lauf der Jahre traten DDT-Resistenzen bei verschiedenen Arten der Anophelesmücke auf. Zudem waren auch die Plasmodien teilweise gegen Chloroquin resistent geworden. Die WHO stellte ihr Programm zur Ausrottung der Malaria 1972 offiziell als gescheitert ein.
Einzelnachweise
- ↑ Trust Sanger Institute und Pain A Böhme U, Berry AE et al.(2008) The genome of the simian and human malaria parasite Plasmodium knowlesi. Nature 455: 751-756 [1]
- ↑ (für Fallzahlen ab 2001): Robert Koch Institute: SurvStat
- ↑ Transfusions-Malaria
- ↑ Empfehlungen der Deutsche Gesellschaft für Tropenmedizin und Internationale Gesundheit e. V.
- ↑ Spektrum der Wissenschaft. 5/2005, S. 20 ff.: "Neue Hoffnung auf Malaria-Impfstoff"
- ↑ The FEBS Journal. 274 (2007), S. 4680 ff.: "Vaccines against malaria-an update"
- ↑ Spektrum der Wissenschaft. 1/2006, S. 10: "Endlich ein Malaria-Impfstoff?"
- ↑ wissenschaft.de: Eingeimpfter Fortpflanzungsstopp vom 26.03.2008
- ↑ Malaria Atlas Projekt
- ↑ Artikel in der Süddeutschen Zeitung
- ↑ Pressemitteilung der EU-Kommission vom 31. Juli 2003
- ↑ Indian-Skeptic
- ↑ News
- ↑ J. Sachs, P. Malaney: The economic and social burden of malaria. in: Nature. London 415.2002, 680–685. doi:10.1038/415680a. PMID 11832956. ISSN 0028-0836
- ↑ B.M.Greenwood, K.Bojang, C.J.Whitty, G.A.Targett: Malaria. in: The Lancet. London 365.2005, 1487–1498. doi:10.1016/S0140-6736(05)66420-3. PMID 15850634 ISSN 0023-7507
- ↑ Malaria bei den Alten Ägyptern. in: Epoc. Spektrum, Heidelberg 2009,1, 10. ISSN 1865-5718, nach: Discovery chanal 8.2008
Siehe auch
- Erreger/Überträger: Parasiten des Menschen, Sporozoen, Protozoeninfektion
- Bekämpfung: Moskitonetz, Zimtöl, DDT, Heptachlor
- Pflanzliche Heilmittel: Sauerdorngewächse, Artemisia (Pflanze) bzw. Einjähriger Beifuß (Artemisinin), auch: Blauer Eisenhut, Gelber Enzian, Cannabis, Schwarzdorn-Akazie, Gewöhnlicher Buchsbaum, Afrikanischer Affenbrotbaum
- Medikamente: Primaquin, Sulfonamid, Tetracycline
- Immunität: Sichelzellenanämie (Erythrozyt), Favismus (G6PD-Mangel), Immunität (Medizin)
Literatur
Deutsche Werke
- Jürgen Knobloch: Malaria - Grundlagen und klinische Praxis. Uni-Med-Verlag, Bremen 2002. ISBN 3-89599-623-8
- Waldemar Malinowski: Impfungen für Auslandsreisende und Malariaprophylaxe. Vademecum für niedergelassene Ärzte. Facultas-Verlag, Wien 2001. ISBN 3-85076-538-5
Englische Werke
- Joel G. Breman, Martin S. Alilio, Anne Mills: The intolerable burden of Malaria II. The American journal of tropical medicine and hygiene. Bd 71, Nr. 2, Supplement. American Society of Tropical Medicine and Hygiene, Northbrook 2004. ISSN 0002-9637
- Peter Perlmann, Marita Troye-Blomberg: Malaria Immunology. Karger, Basel 2002. ISBN 3-8055-7376-6
- David Sullivan, Sanjeev Krishna (Hrsg.): Malaria. Drugs, disease and post-genomic biology. Springer, Berlin 2005. ISBN 3-540-25363-7
- David A. Warrell, Herbert M. Gilles: Essential Malariology. Arnold, London 2002. ISBN 0-340-74064-7
Wissenschaftliche Publikationen
- B. M. Greenwood, K. Bojang, C. J. M. Whitty, G. A. T. Targett: Malaria. in: The Lancet. Elsevier, London 365.2005, S. 1487–1498. ISSN 0023-7507
- Giacomo Maria Paganotti, Claudia Palladino, Mario Coluzzi: Der Ursprung der Malaria. in: Spektrum der Wissenschaft. Heidelberg 2004,3, S. 82–89. ISSN 0170-2971
- August Stich, Katja Fischer, Michael Lanzer: Eine Seuche auf dem Vormarsch - Die Überlebensstrategie des Malariaerregers. in: Biologie in unserer Zeit. 30.2000,4, S. 194–201. ISSN 0045-205X
- Jochen Wiesner, Regina Ortmann, Hassan Jomaa, Martin Schlitzer: Neue Antimalaria-Wirkstoffe. in: Angewandte Chemie. 115.2003,43, S. 5432–5451. ISSN 0044-8249
- I. Stock: Therapie der Malaria. in: Medizinische Monatsschrift für Pharmazeuten. 27.2004,8, S. 260–272. ISSN 0342-9601
- H. Idel: Malaria. Prophylaxe und reisemedizinische Bedeutung. in: Bundesgesundheitsblatt. Springer, Berlin 42.1999,5, S. 402–407. ISSN 1436-9990
- Helge Kampen: Vektor-übertragene Infektionskrankheiten auf dem Vormarsch? Wie Umweltveränderungen Krankheitsüberträgern und -erregern den Weg bereiten. in: Naturwissenschaftliche Rundschau. 58.2005,4, S. 181–189. ISSN 0028-1050
- Margot Kathrin Dalitz: Autochthone Malaria im mitteldeutschen Raum. Dissertation Martin-Luther-Universität, Halle-Wittenberg 2005.
Weblinks
- Malaria – Informationen des Robert Koch-Instituts
- Empfehlungen zur Malariaprophylaxe der Deutschen Gesellschaft für Tropenmedizin und Internationale Gesundheit e. V. (DTG)
- Diagnostik und Therapie der Malaria:
- Triclosan im Kamp gegen Malaria
- Kurzfassung für Patienten. (nicht aktualisiert), **Ausführliche Fassung für Ärzte ohne die Zusatzbezeichnung Tropenmedizin. Deutsche Gesellschaft für Tropenmedizin und Internationale Gesundheit e. V. (DTG)
- WHO World Malaria Report 2005 (englisch)
- WHO-Empfehlungen für die Behandlung der Malaria WHO, Februar 2006 (englisch)
- Süddeutschen Zeitung über ein „Neues altes Mittel gegen Malaria – die Pflanze Artemisia annua“
- Erbgutsequenz von Plasmodium falciparum ist entschlüsselt. (Nature)
- Malaria – eine bekannte Krankheit? (OEW)
- Matthias Giger: "Rückblick in die Geschichte der Malaria und historische Behandlungsmethoden." 1999
- Geschichte der Malaria in den Nordseemarschen (englisch)
- D. Sägesser, B. Thoet: Lernprogramm für Studierende der Medizin. Dissertation Universität Bern, Abteilung für Unterrichtsmedien (AUM). Bern 1999, 2005.
- Interaktive Abfrage von Fallzahlen und Inzidenzen meldepflichtiger Infektionskrankheiten in Deutschland.
- MARA/ARMA Project Malaria-Risikokarten für ganz Afrika zum herunterladen.
- Malaria-Atlas-Projekt finanziert durch den Wellcome Trust (englisch)
- Expedition gegen Malaria auf dem Sambesi (engl.)
- Global Map of Malaria - auf dem WHO World Malaria Report 2008 beruhende interaktive Weltkarte zur Malariasituation
Wikimedia Foundation.


.png)