- Fred Sanger
-
Frederick Sanger OM, CH, CBE (* 13. August 1918 in Rendcombe, Großbritannien) ist ein britischer Biochemiker.
Er gehört zu den wenigen Personen, die zweimal mit dem Nobelpreis geehrt wurden: 1958 erhielt Sanger den Nobelpreis für Chemie (als alleiniger Preisträger) für die Aufklärung der Struktur des Insulins und seine Arbeiten zur Protein-Sequenzierung. 1980 wurde er erneut mit den Nobelpreis für Chemie (diesmal zusammen mit Paul Berg und Walter Gilbert) ausgezeichnet, diesmal für Untersuchungen zur Ermittlung der Basensequenz in Nukleinsäuren.
Inhaltsverzeichnis
Leben
Schule und Studium
Frederick Sanger wurde als zweiter Sohn des Arztes Frederick Sanger senior und Cicely Sanger geboren. Beeinflusst durch den Vater und durch seinen ein Jahr älteren Bruder Theodore entwickelte Sanger schon früh ein Interesse für die Naturwissenschaften. Nach der Schulausbildung an der Bryanston School und am St John's College in Cambridge, wollte er ursprünglich Medizin studieren, entschied sich dann aber für die Biochemie, da er sich als Naturwissenschaftler anders als im Arztberuf stärker auf ein Themengebiet konzentrieren und so vielleicht mehr erreichen könnte. So begann Sanger mit dem Studium der Biochemie am Department of Biochemistry in Cambridge.
1939 erhielt Sanger seinen Abschluss als Bachelor of Arts. Da er aus einer Quäker-Familie kam lehnte er den Kriegsdienst aus Gewissensgründen ab und arbeitete während des Zweiten Weltkrieges an seiner Doktorarbeit weiter, die er im gleichen Institut unter der Betreuung von A. Neuberger über den Metabolismus der Aminosäure Lysin anfertigte. 1943 erhielt er den Doktortitel.
Forschungstätigkeit
Sangers Arbeit wurde 1944 bis 1951 wurde durch ein Beit Memorial Fellowship for Medical Research gefördert. 1951 wurde er externer Mitarbeiter des Medical Research Council (MRC).
Im Jahr seiner Promotion wurde A.C. Chibnall Nachfolger von F.G. Hopkins als Leiter der Biochemie-Abteilung in Cambridge, und Sanger wurde Mitglied in Chibnalls Forschungsgruppe. Das Hauptinteresse der Gruppe galt der Proteinchemie, insbesondere der des Insulins. Sanger entwickelte schließlich eine Methode zur Bestimmung der Aminosäuresequenz, mit deren Hilfe ihm in zwölfjähriger Arbeit die komplette Sequenzbestimmung von Insulin gelang. 1955 konnte die komplette Insulinsequenz veröffentlicht werden, wofür Sanger 1958 mit dem Nobelpreis für Chemie ausgezeichnet wurde.
In der Folge blieb Sanger in Cambridge und übernahm die Leitung der Abteilung für Proteinchemie am Laboratory of Molecular Biology (LMB). Dieses Institut war 1962 als neuer Laborkomplex gebaut worden, nachdem das Medical Research Council schon 1947 in Cambridge eine Gruppe zur „Erforschung der Molekularen Struktur biologischer Systeme“ eingerichtet hatte. Obwohl Sanger bis dahin kein besonderes Interesse an Nukleinsäuren hatte, erkannte er durch die Diskussion mit Wissenschaftlern wie Francis Crick oder Sydney Brenner, die Notwendigkeit, auch die Sequenz dieses anderen Biopolymers zu bestimmen. In den folgenden Jahren widmete sich Sanger daher der Entwicklung einer weiteren Sequenzierungsmethode, die schließlich zum "Kettenabbruchverfahren" führte. 1980 wurde Sanger für seine Beiträge zur Sequenzierung von Nukleinsäuren zum zweiten Mal mit dem Nobelpreis für Chemie ausgezeichnet.
1983 ging Frederick Sanger in den Ruhestand. Heute widmet er sich zusammen mit seiner Frau Margaret Joan seinem Hobby, dem Gärtnern und Segeln. Die Sangers haben drei Kinder.
Auszeichnungen
- 1954 Ernennung zum Fellow der Royal Society (FRS).
- 1958 und 1980: Nobelpreis für Chemie. In der Geschichte des Nobelpreises haben es nur vier Wissenschaftler geschafft, zweimal diese höchste Ehrung zu erhalten (neben Sanger waren das Marie Curie, Linus Pauling und John Bardeen. Sanger und Bardeen sind außerdem die einzigen Menschen, die zweimal mit dem Nobelpreis in derselben Disziplin ausgezeichnet wurden).
- 1963 Verleihung des Ordens Commander of the Order of the British Empire (CBE) durch Königin Elisabeth II.
- 1969 erhielt Sanger die Royal Medal der Royal Society.
- 1981 Aufnahme in den Order of the Companions of Honour (CH).
- 1986 wurde Sanger von Elisabeth II. in den Order of Merit (OM) aufgenommen, dessen reguläre Mitgliedschaft auf nur 24 Personen begrenzt ist.
- 1988 wurde Sanger korrespondierendes Mitglied der Bayerischen Akademie der Wissenschaften[1].
- 1992 wurde in Cambridge das nach Frederick Sanger benannte Sanger Center gegründet, dessen Ziel die Sequenzierung und Erforschung des menschlichen Genoms und Genomen anderer Organismen ist.
- 1997 wurde die Abteilung für Biochemie der Universität Cambridge, wo Sanger bis 1962 gearbeitet hatte, erweitert. Neben dem „Hopkins-Gebäude“ gibt es jetzt ein zweites, das „Sanger-Gebäude“.
Werk
Methode zur Bestimmung der Aminosäuresequenz
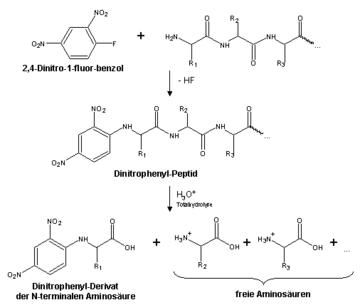
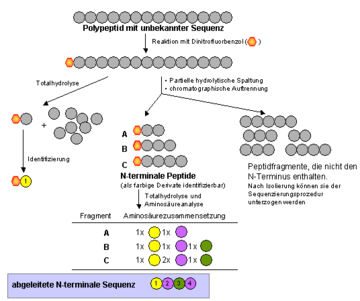
Sangers Methode zur Bestimmung der Aminosäuresequenz entstand in seiner Zeit als Mitglied in A.C. Chibnalls Forschungsgruppe in Cambridge. In den 40er Jahren erlebte die Proteinchemie eine Revolution durch die Entwicklung effizienter chromatographischer Trennungsmethoden für Proteine, Peptide und Aminosäuren. Sanger sah nun eine Zeit gekommen, in der es möglich sein sollte, die Reihenfolge der Aminosäuren in einem Protein (Aminosäuresequenz) zu bestimmen. Dazu sollte die Proteinkette zunächst in kleine Peptidfragmente zerlegt werden, die dann mit Hilfe der neuen Methoden isoliert werden sollten. Zur Markierung und späteren Identifizierung der endständigen Aminosäure setzte Sanger die Fragmentpeptide mit 2,4-Dinitro-1-fluorbenzol um. Die am N-Terminus derivatisierten Peptide wurden komplett in ihre Aminosäuren gespalten, deren relative Mengen anschließend quantitativ bestimmt wurden. Die Identität der endständigen Aminosäure konnte durch chromatographische Analyse des farbigen Dinitrophenyl (DNP)-Derivats bestimmt werden. In diesem Arbeitsgang erhielt man zwei Informationen: 1. die Identität der ersten Aminosäure in der Kette und 2. welche anderen Aminosäuren auch noch in der Kette enthalten sind (wenngleich man auch nicht deren Position kennt). Wird ein DNP-Peptid mit bekannter Aminosäurezusammensetzung in kürzere Fragmente zerlegt, und bestimmt man erneut die Zusammensetzung der kürzeren Fragmente, so kann man schließlich Rückschlüsse auf die ursprüngliche Sequenz ziehen. Die Abbildung verdeutlicht das Prinzip der Sequenzierungsmethode an einem kleinen Peptid.
In zwölfjähriger Arbeit gelang Sanger die komplette Sequenzbestimmung von Insulin. Erschwerend kam hinzu, dass Insulin ein Protein ist, das aus zwei Polypeptidketten besteht, die über Disulfidbrücken miteinander verbunden sind. Die Anordnung dieser Verbrückungen musste ebenfalls bestimmt werden. 1955 wurde die komplette Insulinsequenz veröffentlicht. Damit wurde erstmals bewiesen, dass Proteine eine eindeutige chemische Struktur besitzen. Jetzt konnten frühere Hypothesen, z. B. dass Proteine zwar eine definierte Aminosäurezusammensetzung, jedoch mit zufälliger Sequenz, besitzen oder dass Proteine gar Aggregate kleinerer ähnlicher Einheiten sind, endgültig verworfen werden. 1958 wurde Sanger für diese Arbeiten mit dem Nobelpreis für Chemie ausgezeichnet.
Sangers Sequenzierungsmethode wurde später durch den von dem schwedischen Biochemiker Pehr Edman entwickelten Phenylisothiocyanat-Abbau verdrängt. Der wesentliche Vorteil der Edman-Methode bestand darin, dass man Aminosäuren sukzessive vom N-Terminus her abbauen und identifizieren konnte. Das um eine Aminosäure verkürzte Restpeptid konnte anschließend einem erneuten Abbauzyklus unterzogen und so die Sequenz relativ schnell bestimmt werden.
Methode zur Sequenzierung von Nukleinsäuren
- Hauptartikel: DNA-Sequenzierung#Didesoxymethode nach Sanger
Sangers Methode zur Sequenzierung von Nukleinsäuren entstand in seiner Zeit als Leiter der Abteilung für Proteinchemie am Laboratory of Molecular Biology (LMB) in Cambridge. Sie entstand aus der Notwendigkeit, die Sequenz der Nukleinbasen zu bestimmen.
Sanger entwickelte zum Erreichen dieses Ziels zunächst eine Methode zur Sequenzierung von Ribonukleinsäuren (RNA), die er dann auf Desoxyribonukleinsäure (DNA) anwandte. Diese Methode war jedoch sehr langsam und erlaubte nur die Bestimmung kurzer Sequenzabschnitte. In der Folgezeit entwickelte er eine neue Methode, die die Grundlage für die heutige DNA-Sequenzierungsmethode werden sollte, die sogenannte Didesoxymethode. Diese Technik nutzt folgende Eigenschaften der DNA:
- Die DNA ist ein doppelsträngiges Molekül, einer gewundenen Strickleiter nicht unähnlich. Die Sprossen der Leiter bilden Paare der Nukleinbasen (Adenin, Guanin, Thymin und Cytosin), von denen es nur zwei Kombinationen gibt: Adenin steht Thymin gegenüber, Cytosin ist mit Guanin gepaart.
- Trennt man die beiden Einzelstränge auf, so kann man mit Hilfe einer DNA-Polymerase den Komplementärstrang synthetisieren. Allerdings braucht man ein kleines komplementäres DNA-Stück (Primer), das man an den Einzelstrang bindet und von der Polymerase gemäß der Instruktion des Gegenstranges (Template-Strang) verlängert wird.
Das synthetisierte DNA-Stück hat also einen definierten Anfangspunkt. Die Syntheseprodukte jedoch können unterschiedliche Längen haben, die Länge hängt davon ab, wieviele freie Nukleotide zur Synthese zur Verfügung stehen oder ob die Polymerase zufällig von dem Matrizenstrang abfällt.
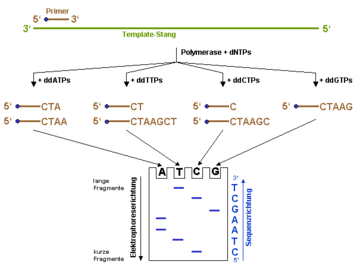 Prinzip der DNA-Sequenzierung nach der Didesoxy-Methode.
Prinzip der DNA-Sequenzierung nach der Didesoxy-Methode.
dNTP ist die allgemeine Abkürzung für ein Nucleotid und kann für dATP, dCTP, dGTP oder dTTP stehen. ddNTPs sind die entsprechenden Didesoxy-Varianten der dNTPs. Der Einbau eines ddNTPs führt zum Abbruch der Polymerisationsreaktion. Die blauen Punkte am 5'-Ende des Primers stellt eine Markierung dar (z. B. eine fluoreszierende Gruppe), mittels der die Syntheseprodukte später im Gel sichtbar gemacht werden können. Alternativ lassen sich auch radioaktiv markierte Nucleotide zur Polymerisationsreaktion einsetzen.Sangers Trick besteht nun darin, die Polymerisationsreaktion in vier getrennten Ansätzen durchzuführen, und dafür zu sorgen, dass jeder Strang den gleichen Start hat (was durch den Primer gegeben ist) und dass die Verlängerungsreaktion – obwohl an unterschiedlichen Stellen – aber immer an einer bestimmten Basensorte enden soll. Um das zu gewährleisten, enthält jeder Reaktionsansatz neben den vier Nukleotid-Monomeren jeweils die Didesoxy-Variante einer Nukleotidsorte. Die Kettenverlängerung läuft solange, bis schließlich irgendwann ein Didesoxy-Nukleotid eingebaut wird. Damit fehlt die 3'-OH-Gruppe zur Ausbildung der Phosphodiesterbindung zum nächsten Kettenglied und die Synthese stoppt hier. Durch die Festlegung des Anfangspunktes spiegelt die Länge der Synthesefragmente in einem Reaktionsansatz die relative Position der jeweiligen Nucleinbasensorte im Molekül wider. Setzt man radioaktiv (oder andersartig markierte) Nucleotide zur Reaktion ein und trennt die vier Ansätze nebeneinander entsprechend ihrer Größe in einem Acrylamidgel auf, so kann man die Basensequenz direkt vom Gel ablesen. Die nebenstehende Abbildung verdeutlicht das Prinzip der Didesoxy-Sequenzierung.
1977 präsentierten Sanger und Mitarbeiter die komplette Sequenz des 5.386 Basenpaare großen Bakteriophagen PhiX174. Aus der Sequenz dieses Bakterienvirus konnte direkt die Aminosäuresequenz der zehn viralen Proteine abgelesen werden, da der genetische Code, der angibt welche Dreierabfolge von Nukleinbasen (Basentriplett) für welche Aminosäure in einem Protein kodiert, durch Pionierarbeiten in den 1960er Jahren bekannt war. 1980 wurde Sanger für seine Beiträge zur Sequenzierung von Nukleinsäuren zum zweiten Mal mit dem Nobelpreis ausgezeichnet.
Die Bedeutung von Sangers Arbeit für die Gentechnik und das Genom-Projekt
Anfang der 1970er Jahre wurden Klonierungsmethoden entwickelt, mit denen man DNA-Stücke beliebigen Ursprungs in Bakterien vermehren kann, so dass genügend Material für die Sequenzierung zur Verfügung steht. Damit eröffnete sich die Möglichkeit, die gesamte genetische Information eines Organismus, das Genom, zu sequenzieren und damit indirekt auch die Sequenzen aller von diesem Organismus theoretisch synthetisierbaren Proteine abzuleiten. Zusammen mit Stanley Cohen und Paul Berg, den Erfindern der rekombinanten Klonierungstechnik, kann Frederick Sanger daher als Vater der Gentechnik und des Genom-Projekts bezeichnet werden.
Zitate
- „Of the three main activities involved in scientific research, thinking, talking, and doing, I much prefer the last and am probably best at it. I am all right at the thinking, but not much good at the talking.“[2]
- „Previously I had not had much interest in nucleic acids. I used to go to Gordon Conferences on Protein and Nucleic Acids when the two subjects were bracketed together, and would sit through the nucleic acid talks waiting to get back to proteins. However, with people like Francis Crick around, it was difficult to ignore nucleic acids or to fail to realize the importance of sequencing them.“[3]
- „Unlike many scientists, I decided to retire and give up research when I reached the age of 65. This surprised my colleagues, and to some extent myself also. I had not thought about retirement until I suddenly realized that in a few years I would be 65 and would be entitled to stop work and do some of the things I had always wanted to do and had never had time for. The possibility seemed surprisingly attractive, especially as our work had reached a climax with the DNA sequencing method and I rather felt that to continue would be something of an anticlimax.“[4]
Einzelnachweise
- ↑ Korrespondierende Mitglieder, BAdW
- ↑ Frederick Sanger: Sequences, Sequences, and Sequences. In: Frederick Sanger, Margaret Dowding (Hrsg.): Selected Papers of Frederick Sanger: With Commentaries. World Scientific, Singapore / River Edge / London 1996, ISBN 9810224303, S. 635 (Introduction).
- ↑ Frederick Sanger: Sequences, Sequences, and Sequences. In: Frederick Sanger, Margaret Dowding (Hrsg.): Selected Papers of Frederick Sanger: With Commentaries. World Scientific, Singapore / River Edge / London 1996, ISBN 9810224303, S. 648.
- ↑ Frederick Sanger: Sequences, Sequences, and Sequences. In: Frederick Sanger, Margaret Dowding (Hrsg.): Selected Papers of Frederick Sanger: With Commentaries. World Scientific, Singapore / River Edge / London 1996, ISBN 9810224303, S. 660.
Literatur
Wichtige Originalarbeiten:
- zur Proteinsequenzierung
- F. Sanger (1949): The terminal peptides of insulin. Biochem J. 45:563-74.
- A.P. Ryle, F. Sanger u. R. Kitai (1955): The disulphide bonds of insulin. Biochem J.' 60:541-56.
- zur DNA-Sequenzierung
- F. Sanger, S. Nicklen und A.R. Coulson AR (1977): DNA sequencing with chain-terminating inhibitors. Proc Natl Acad Sci U S A 74:5463-7.
- F. Sanger F u.a. (1977): Nucliotide sequence of bacteriophage phi X174 DNA. Nature 265:687-95.
- Autobiographisches, Übersichtsartikel
- F. Sanger (1988): Sequences, sequences, and sequences. Annu Rev Biochem. 57:1-28.
- F. Sanger (2001): The early days of DNA sequences. Nat Med. 7:267-8.
Weblinks
- Informationen der Nobelstiftung zur Preisverleihung 1958 an Frederick Sanger (englisch)
- Informationen der Nobelstiftung zur Preisverleihung 1980 an Frederick Sanger (englisch)
- The Sanger Centre
- Autobiographie
PND: kein individualisierter Datensatz vorhanden (Stand: 8.3.2008) Personendaten NAME Sanger, Frederick KURZBESCHREIBUNG britischer Biochemiker und Nobelpreisträger für Chemie GEBURTSDATUM 13. August 1918 GEBURTSORT Rendcombe, Großbritannien
Wikimedia Foundation.