- GPCR
-
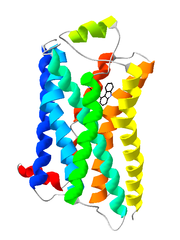
 Bändermodell des G-Protein-gekoppelten Rezeptors Rhodopsin.
Bändermodell des G-Protein-gekoppelten Rezeptors Rhodopsin.Der Begriff G-Protein-gekoppelter Rezeptor (kurz GPCR, für englisch G protein-coupled receptor) wird in der Biologie für Rezeptoren in der Zellmembran verwendet, die Signale über GTP-bindende Proteine (kurz G-Proteine) in das Zellinnere weiterleiten (Signaltransduktion). Diese stellen die größte und vielseitigste Gruppe von Membranrezeptoren dar. In der Neurobiologie wird für G-Protein-gekoppelte Rezeptoren häufig der Begriff metabotrope Rezeptoren verwendet, um sie von einem anderen Rezeptortyp, den ligandengesteuerten Ionenkanälen (Ionotroper Rezeptor), zu unterscheiden.
G-Protein-gekoppelte Rezeptoren sind für die Verarbeitung von Licht-, Geruchs- und einer Vielzahl von Geschmacksreizen verantwortlich. Sie spielen eine entscheidende Rolle bei Entzündungsprozessen, der gezielten Zellbewegung (Chemotaxis), dem Transport von Stoffen durch die Zellmembran (Endozytose und Exocytose) sowie beim Zellwachstum und bei der Zelldifferenzierung. Sie sind darüber hinaus als Zielstrukturen für die Wirkung von Hormonen, wie Adrenalin oder Glucagon, und Neurotransmittern, wie Serotonin und Acetylcholin, verantwortlich. Auch einige Viren nutzen G-Protein-gekoppelte Rezeptoren als Bindungsstellen für den Eintritt in die Zelle (beispielsweise HIV).
Inhaltsverzeichnis
Definition
Als G-Protein-gekoppelte Rezeptoren im engeren Sinn werden alle heptahelikalen Rezeptoren bezeichnet, die zur Bindung und Aktivierung von G-Proteinen befähigt sind. Zusätzlich zur Bindung von G-Proteinen sind viele dieser Rezeptoren in der Lage, auch mit anderen signalweiterleitenden Proteinen zu interagieren. Als G-Protein-gekoppelte Rezeptoren werden, wie im Fall vieler sogenannter "Orphan-GPCRs", auch Rezeptorproteine bezeichnet, für die eine Kopplung mit G-Proteinen lediglich vermutet wird. Bisweilen wird dieser Begriff auch auf Rezeptoren angewandt, die zwar nicht zur Bindung und Aktivierung von G-Proteinen befähigt sind, jedoch auf Grund ihrer phylogenetischen Verwandtschaft mit anderen, der klassischen Definition genügenden G-Protein-gekoppelten Rezeptoren dieser Familie zurechnet werden können.
Dem gegenüber werden prokaryotische Rhodopsine, die zwar in ihrer Struktur eukaryotischen G-Protein-gekoppelten Rezeptoren ähneln, aber nicht zur Bindung von G-Proteinen befähigt sind und als Ionenkanäle fungieren, nicht der Familie der G-Protein-gekoppelten Rezeptoren zugeordnet.
Vorkommen
G-Protein-gekoppelte Rezeptoren kommen in fast allen Lebewesen vor, nicht nur in Wirbeltieren und Wirbellosen, sondern auch in Protozoen (z. B. Amöben) und in Pilzen (beispielsweise in Hefen). Auch im Pflanzenreich konnte das Vorkommen G-Protein-gekoppelter Rezeptoren am Beispiel der Acker-Schmalwand und des Reis nachgewiesen werden. Hier wird eine Rolle als Rezeptor für Phytohormone diskutiert. Einige Fotorezeptoren mit einer Struktur, die G-Protein-gekoppelten Rezeptoren ähnelt, können sogar in Archaeen gefunden werden (Bacteriorhodopsine). Diese Rezeptoren haben jedoch keine Verwandtschaft zu Fotorezeptoren höherer Tiere und werden in der Regel nicht der Familie der G-Protein-gekoppelten Rezeptoren zugerechnet.
Beim Menschen konnten bisher etwa 800 G-Protein-gekoppelte Rezeptoren identifiziert werden. Diese werden durch etwa 3 % des menschlichen Genoms kodiert. Mehr als die Hälfte der G-Protein-gekoppelten Rezeptoren des Menschen werden den Geruchsrezeptoren (olfaktorischen Rezeptoren) zugeordnet. Bei über 140 der ca. 800 G-Protein-gekoppelten Rezeptoren ist der endogene Ligand nicht bekannt und sie werden deshalb als Orphan-GPCRs bezeichnet.[1]
Struktur
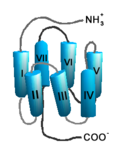
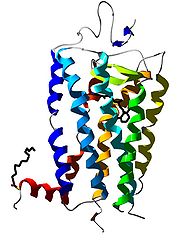
Auf Grund ihrer Struktur gehören G-Protein-gekoppelte Rezeptoren der Superfamilie der heptahelikalen Transmembranproteine (gebräuchliche Synonyme: Sieben-Transmembrandomänen-Rezeptoren, 7-TM-Rezeptoren und heptahelikale Rezeptoren) an. Sie bestehen aus Untereinheiten mit sieben (griechisch „hepta“) die Zellmembran durchspannenden (transmembranären) Helixstrukturen, die durch drei intrazelluläre und drei extrazelluläre Schleifen miteinander verbunden sind. G-Protein-gekoppelte Rezeptoren besitzen eine extrazelluläre oder transmembranäre Bindungsdomäne für einen Liganden. Das G-Protein bindet an der zellinneren (intrazellulären) Seite des Rezeptors.
Lange Zeit war nur die Struktur von GPCRs bei Bakterien bekannt. Die dreidimensionale Strukturaufklärung eines G-Protein-gekoppelten Rezeptors bei Vertebraten, des bovinen Rhodopsins, gelang im Jahr 2000 mit Hilfe der Röntgenstrukturanalyse [2]. Die Kristallisierung und Strukturaufklärung anderer G-Protein-gekoppelter Rezeptoren ist hingegen wegen ihrer physikochemischen Eigenschaften und aufgrund der geringen Rezeptordichte in der Membran erschwert. Daher konnte erst im Jahr 2007 die Kristallstruktur eines ligandenaktivierten G-Protein-gekoppelten Rezeptors (menschlicher β2-Adrenozeptor) aufgeklärt werden [3]. Im Juni 2008 schließlich folgte eine Kristallstruktur des β1-Adrenozeptors vom Truthuhn[4] und im Oktober 2008 die Kristallstruktur des A2A-Adenosinrezeptors[5]. Somit liegen derzeit von vier bei Wirbeltieren vorkommenden GPCRs Kristallstrukturen vor. Zudem ist noch mit dem Rhodopsin des japanischen Fliegenden Kalmars die Struktur eines GPCRs bei Invertebraten bekannt.
Transmembrandomänen
Die sieben membrandurchspannenden helikalen Domänen G-Protein-gekoppelter Rezeptoren, die bei Sicht auf den Rezeptor von der extrazellulären Seite aus entgegen dem Uhrzeigersinn angeordnet sind, sind für die Verankerung des Rezeptors in der Zellmembran verantwortlich. Insbesondere die Transmembrandomänen III–VI beherbergen Bindungsstellen für einen Liganden. Den Transmembrandomänen I, II und IV kommt möglicherweise eine Rolle bei der Di- und Oligomerisierung von G-Protein-gekoppelten Rezeptoren zu.
Im Gegensatz zu den extrazellulären und intrazellulären Domänen sind die Transmembrandomänen innerhalb der Familie G-Protein-gekoppelter Rezeptoren stark konserviert. Einige Aminosäuresequenzen (Motive) innerhalb der Transmembrandomänen sind für viele G-Protein-gekoppelte Rezeptoren charakteristisch. Beispielsweise können das E/DRY-Motiv der Transmembrandomäne III und das NPxxY-Motiv der Transmembrandomäne VII in fast allen Rhodopsin-ähnlichen Rezeptoren gefunden werden. Ihnen wird eine wichtige Rolle bei der Rezeptoraktivierung zugeschrieben.
Extrazelluläre Domänen
Einige G-Protein-gekoppelte Rezeptoren, wie z. B. die metabotropen Glutamatrezeptoren, besitzen in ihrer extrazellulären N-terminalen Domäne ihre primäre Ligandenbindungsstelle. Diese Rezeptoren sind durch lange N-terminale Aminosäuresequenzen gekennzeichnet (bis 2800 Aminosäuren), während Rezeptoren mit intrazellulären Ligandenbindungsdomänen meist nur kurze Reste aufweisen (meist unter 30 Aminosäuren). Der N-Terminus und die extrazellulären Domänen des Rezeptors sind häufig glykosyliert. In der zweiten extrazellulären Schleife (EL 2) und am Anfang der dritten transmembranären Domäne des Rezeptors befinden sich zwei konservierte, zur Disulfidbrückenbildung befähigte Cysteine, welche die Struktur des Rezeptors stabilisieren, indem sie die Transmembrandomänen III bis V aneinander binden.
Intrazelluläre Domänen
Die intrazelluläre Seite des Rezeptors ist mit Bindungsstellen für G-Proteine und andere Signalmoleküle ausgestattet. An der Bindung von G-Proteinen sind insbesondere die transmembrandomänennahen Aminosäuren der zweiten (IL2) und dritten intrazellulären Schleife (IL 3) sowie der sich an die 7. transmembranäre Domäne anschließende C-terminale Rest, beteiligt. Der intrazelluläre C-terminale Anteil ist in der Regel sehr kurz (meist unter 50 Aminosäuren). Einigen G-Protein-gekoppelten Rezeptoren, wie beispielsweise dem Gonadotropin-Releasing-Hormon-Rezeptor, fehlt dieser Teil. Direkt an das intrazelluläre Ende der 7. transmembranären Domäne kann sich auch noch eine mit einem konservierten Cystein beginnende achte Helix (Hx 8) anschießen, die parallel zur Zellmembran verläuft.
Funktion
Die Hauptfunktion der G-Protein-gekoppelten Rezeptoren besteht in der Weiterleitung von Signalen in das Zellinnere. Diese Signalweiterleitung (Signaltransduktion) geschieht insbesondere über die Aktivierung von G-Proteinen. Einige G-Protein-gekoppelte Rezeptoren sind auch zu einer G-Protein-unabhängigen Signaltransduktion, beispielsweise über Arrestine, befähigt.
Aktivierung von G-Proteinen
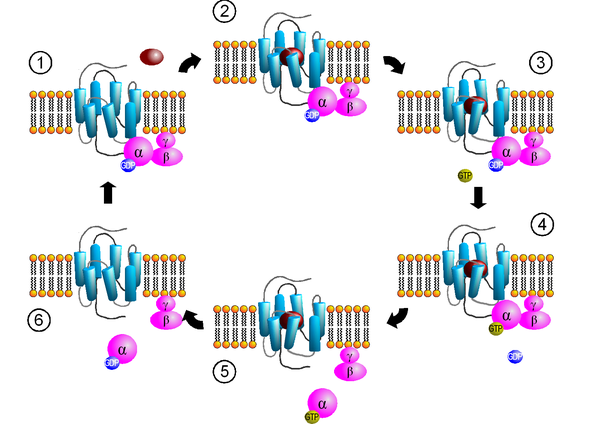
Nahezu alle G-Protein-gekoppelten Rezeptoren sind zu einer direkten Aktivierung eines aus drei Untereinheiten (α, β und γ) bestehenden (heterotrimeren) G-Proteins befähigt. Die Aktivierung eines G-Proteins ist ein mehrstufiger Prozess, der die Bindung eines Liganden an den Rezeptor, die Konformationsänderung des Rezeptors sowie die Bindung und Aktivierung eines G-Proteins einschließt und dabei den Gesetzen der Thermodynamik unterliegt.
Schritt 1: Bindung des G-Proteins
Aktivierte Rezeptoren interagieren mit heterotrimeren G-Proteinen, die dadurch selbst aktiviert werden. Der Rezeptor zeigt dabei eine Selektivität für ein (beispielsweise β1-Adrenozeptor: Gs) oder für mehrere verschiedene (z. B. β2-Adrenozeptor: Gs und Gi/o) G-Proteinsubtypen. Dieser Komplex aus Rezeptor und heterotrimeren G-Protein ist dabei ein Bestandteil eines größeren Netzwerks, an dem auch weitere signalweiterleitende Proteine, wie z. B. GIRK-Kanäle, Phospholipase C und Proteinkinase C beteiligt sind[6]. Mit Hilfe dieses Netzwerks kann eine schnelle, oft nur Millisekunden bis wenige Sekunden dauernde Aktivierung der Signaltransduktionskaskade G-Protein-gekoppelter Rezeptoren erklärt werden. Ob der Rezeptor mit dem G-Protein durch Kollisionskopplung interagiert, oder ob Rezeptoren auch im inaktiven Zustand mit dem G-Protein assoziiert sind ist Gegenstand aktueller Forschung[7].
Schritt 2: Ligandenbindung
Wikimedia Foundation.