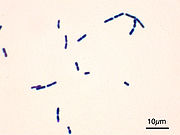
- Gram-positive
-
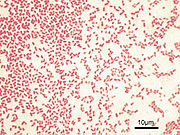 Pseudomonas aeruginosa, lichtmikroskopisch, Gram-Färbung: gramnegativ
Pseudomonas aeruginosa, lichtmikroskopisch, Gram-Färbung: gramnegativDie Gram-Färbung ist eine Methode zur differenzierenden Färbung von Bakterien. Sie ist nach dem dänischen Arzt und Bakteriologen Hans Christian Gram benannt, der sie am Ende des 19. Jahrhunderts entwickelte.
Bakterien werden aufgrund der Färbung in zwei Gruppen unterteilt
- grampositive Bakterien, die nach dem Färbegang dunkelblau erscheinen, und
- gramnegative Bakterien, die ungefärbt sind. Sie werden üblicherweise nachträglich mittels Fuchsin oder Safraninlösung rot gefärbt.
Inhaltsverzeichnis
Bedeutung und Ursachen
Die Gramfärbung ist ein wichtiges Kriterium für die Unterscheidung von Bakterien nach dem Aufbau ihrer Zellwand. Sie beruht auf dem unterschiedlichen Aufbau der Bakterienhülle aus verschiedenen Peptidoglycanen (Murein) sowie Teichonsäuren. Grampositive Bakterien besitzen dabei eine dickere, mehrschichtige Mureinhülle, die durch basische Farbstoffe anfärbbar ist und bis zu 50 % der Hüllentrockenmasse ausmachen kann. Zusätzlich enthält die Zellwand hier zwischen 20 und 40 % Teichonsäuren. Gramnegative Bakterien dagegen haben nur eine dünne, einschichtige Mureinhülle, die nicht färbbar ist, nur etwa 10 % der Trockenmasse der Bakterienhülle ausmacht und keine Teichonsäuren enthält.[1] Bedeutend ist das Färbeverfahren insbesondere bei der Diagnostik von Infektionskrankheiten. „Grampositive“ und „gramnegative“ Bakterien reagieren unterschiedlich auf Antibiotika. Nach Trocknung (je nach Materialart etwa 5-15 Minuten) und Fixierung (in der Regel Hitzefixierung) des Bakterienausstrichs wird mit dieser schnellen diagnostischen Methode in etwa fünf Minuten das „Gramverhalten“ bestimmt. Damit hat man die Möglichkeit, sofort mit der antibiotischen Therapie zu beginnen, bevor das Ergebnis der mindestens 24 Stunden dauernden kulturellen Erregeranzucht mit nachfolgender Bestimmung vorliegt.
Methode der Gram-Färbung
Die Färbung setzt sich aus drei Stufen zusammen, die „Färben“, „Entfärben“ und „Gegenfärben“ genannt werden.
In der ersten Phase wird mit Karbol-Gentianaviolett (eine Lösung von Gentianaviolett mit Zusatz von 15 g/l Phenol) eingefärbt, wodurch alle Bakterien, grampositive wie auch gramnegative, gefärbt werden. Durch eine nachfolgende Behandlung mit Lugolscher Lösung bilden sich größere Farbstoff-Komplexe, die Bakterien erscheinen dunkel blau.
In der entscheidenden zweiten Phase verhalten sich grampositive und gramnegative Bakterien verschieden: Die Behandlung mit Alkohol (96 % Ethanol) führt dazu, dass gramnegative Bakterien wieder entfärbt werden, während bei grampositiven Bakterien die blauen Farbstoff-Komplexe mit dem Alkohol nicht ausgewaschen werden können. Dieser Unterschied ist auf den Aufbau der Zellwand zurückzuführen:
- Grampositive Bakterien besitzen eine der Membran aufgelagerte dicke, mehrschichtige Mureinhülle (Peptidoglykane), in den Zwischenräumen sammelt sich die Lugolsche Lösung an. Hier wirkt der Alkohol dehydrierend und verringert den Abstand zwischen den Molekülen, so dass die Farbstoff-Komplexe nicht vom Alkohol ausgewaschen werden können.
- Gramnegative Bakterien hingegen besitzen nur eine dünne Mureinhülle, der zusätzlich eine zweite Lipid-Membran aufgelagert ist. Der Alkohol wirkt hier lipidlösend, so dass die dünne Mureinhülle freigelegt wird. Die Farbstoff-Komplexe werden vom Alkohol ausgewaschen – das Bakterium wird entfärbt.
Die Behandlungen mit Lugolscher Lösung und mit Alkohol sind somit die entscheidenden Schritte bei der Gramfärbung.
Zur Darstellung der gramnegativen Bakterien können diese abschließend mit verdünntem Karbolfuchsin (eine Lösung von Fuchsin mit Zusatz von 4,5 g/l Phenol, Fuchsin und Phenol etwa 1/10 der üblichen Konzentration) gegengefärbt werden, worauf sie rot erscheinen. Dies ist jedoch in der heutigen Praxis nicht mehr nötig, wenn die Phasenkontrastmikroskopie angewendet wird.
Andere Methoden zur Unterscheidung von grampositiven und gramnegativen Bakterien
KOH-Test
Eine kleine Menge Bakterienmasse (von einer Agar-Kultur) wird in einem Tropfen 3 %iger KOH-Lösung suspendiert. Bei grampositiven ist diese Lauge zu schwach, um die Zellwand zu lysieren. Zieht man eine Nadel oder einen Zahnstocher durch das Gemisch, verhält es sich wie eine Flüssigkeit mit einer Viskosität wie Wasser (keine Fadenbildung zu erkennen). Die Zellwand von gramnegativen Bakterien dagegen ist wesentlich dünner und wird durch die Kalilauge lysiert. Die Zellen brechen auf und die DNA wird freigesetzt. Wird die Nadel durch diese Lösung gezogen, kann aufgrund der erhöhten Viskosität durch die freigesetzte DNA eine Fadenbildung beobachtet werden. Es sei betont, dass es sich hier um einen Schnelltest handelt, der nur bedingt zuverlässig ist. Für Anfänger ist es oft schwer, eine Fadenbildung zu erkennen. Eine Fehlerquelle hierbei kann des Weiteren auch die Verwendung einer falschen Laugenkonzentration darstellen. Ist diese zu stark, werden auch gram-positive Bakterien lysiert. Ist sie hingegen zu schwach, werden auch gram-negative Bakterien nicht lysiert.
Aminopeptidasetest
Der Aminopeptidasetest beruht darauf, dass das Enzym L-Alaninaminopeptidase, von wenigen Ausnahmen abgesehen, nur bei gramnegativen Bakterien nachgewiesen werden kann. Eine kleine Menge der zu untersuchenden Bakterien wird in einem Reagenzglas oder Eppendorfcup in etwas sterilem, destilliertem Wasser suspendiert. Zum Nachweis wird L-Alanin-4-nitroanilid verwendet, welches durch das Enzym unter Spaltung einer Amidbindung in L-Alanin und das gelb gefärbte 4-Nitroanilid gespalten wird. Somit zeigt eine Gelbfärbung der Suspension das Vorliegen eines Gram-negativen Bakteriums an. Für diese Reaktion sind industriell hergestellte Teststreifen erhältlich. Es ist ratsam hierbei immer eine Negativkontrolle mit anzusetzen um einen Vergleich zu haben. Außerdem ist der Test nur bei Bakterienkolonien ohne starke Eigenfärbung anwendbar.
Historisches
Der dänische Mediziner Hans Christian Gram entwickelte die Färbemethode als Mitarbeiter bei Carl Friedländer in Berlin. Er suchte nach einer Färbemethode, mit der Bakterien in tierischen Geweben dargestellt werden können, also kontrastierend zu den Gewebezellen gefärbt wurden. Die gefundene Färbemethode, veröffentlicht 1884, hatte jedoch nur bei einigen Bakterien, den grampositiven, Erfolg. Émile Roux wendete die Methode zur färberischen Differenzierung von grampositiven und gramnegativen Bakterien an, insbesondere zur Bestimmung von Gonokokken (gramnegativ im Gegensatz zu vielen anderen Kokken) (Veröffentlichung 1886).
Grampositive Bakterien
Beispiele für grampositive Bakterien: Alle Arten der Stämme Actinobacteria (etwa die Aktinomyzeten) und Firmicutes. Beispiele für Firmicutes: Streptococcus, Enterococcus, Staphylococcus, Listeria, Bacillus, Clostridium, Lactobacillus, Erysipelothrix rhusiopathiae.
Eine Ausnahme des Stammes Firmicutes, zu dem eigentlich nur grampositive Bakterien gestellt werden, bildet die Gattung Veillonella der Familie Acidaminococcaceae). Gattungen dieser Familie sind gramnegativ.
Gramnegative Bakterien
Beispiele für gramnegative Bakterien: Alle Arten der Abteilung Proteobacteria sind gramnegativ, so die Enterobakterien (Escherichia coli, Salmonella, Shigella, Klebsiella, Proteus, Enterobacter). Weitere Beispiele der Proteobakterien: Pseudomonas, Legionella, Neisseria, Rickettsia, Pasteurella multocida.
Auch Streptobacillus moniliformis (eine Art des Stammes Fusobacteria), Meningococcus, Chlamydophila, Chlamydia, die Spirochäten, alle Arten des Stammes Bacteroidetes und die Cyanobakterien sind gramnegativ.
Literatur
C. Gram: Über die isolirte Färbung der Schizomyceten in Schnitt- und Trockenpräparaten. In: Fortschritte der Medicin. Vol. 2, 1884, S. 185-189.
Einzelnachweise
- ↑ Wissenschaft-Online-Lexika: Eintrag zu Murein im Lexikon der Biologie, abgerufen am 22. November 2008.
Weblinks
Wikimedia Foundation.