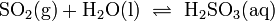- H2SO3
-
Strukturformel 
Allgemeines Name Schweflige Säure Andere Namen - Schwefel(IV)-säure
- Schwefligsäure (IUPAC)
Summenformel H2SO3 CAS-Nummer 7782-99-2 Kurzbeschreibung farblose Flüssigkeit mit stechendem Geruch nach Schwefeldioxid [1] Eigenschaften Molare Masse 82,02 g·mol−1 Aggregatzustand flüssig [1]
Dichte 1,03 g·cm−3 [1]
pKs-Wert 1,81; 6,99 [2]
Löslichkeit vollständig mischbar mit Wasser, nur in Lösung beständig [1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Ätzend (C) R- und S-Sätze R: 20-34 S: 26-36/37/39-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Die Schweflige Säure (nach der Nomenklatur der IUPAC Dihydrogensulfit genannt) ist eine unbeständige, nur in wässriger Lösung existierende, schwache Säure, die beim Lösen von Schwefeldioxid in Wasser entsteht; ihre Salze heißen Sulfite und Hydrogensulfite.
Das Gleichgewicht der Reaktion liegt weit auf der linken Seite[2].
Versucht man die Lösung einzudampfen, um wasserfreie Schweflige Säure zu erhalten, so zerfällt diese in Umkehrung der Bildungsreaktion. Beim Abkühlen kristallisiert ein Clathrat SO2 · 5,75 H2O aus, das sich bei 7 °C wieder zersetzt. Freie Schweflige Säure H2SO3 ist daher nicht isolierbar.
Schweflige Säure bildet in Wasser zwei einwertige tautomere Anionen, das Hydrogensulfit- und das Sulfonat-Ion mit den Strukturen HSO3− und SHO3−, die sich als Deprotonierungsprodukte von der Schwefligen Säure bzw. der Sulfonsäure ableiten lassen.
Versetzt man Schweflige Säure mit Basen, Metalloxiden oder Carbonaten, so kristallisieren mit dem Eindampfen der Lösungen die Salze der Schwefligen Säure, die Sulfite, aus.
Die Hydrogensulfite lassen sich nur mit großen Kationen auskristallisieren, ansonsten entstehen Disulfite. Im Feststoff liegt das Hydrogensulfit-Anion in der Konstitution eines Sulfonats vor, der restliche Wasserstoff ist an den Schwefel gebunden[2].
Schweflige Säure ist auch Mitverursacher des sauren Regens, da das bei der Verbrennung fossiler Brennstoffe (beispielsweise Kohle, Erdöl, Erdölprodukte) oder Biomasse gebildete Schwefeldioxid vom Regenwasser aus der Atmosphäre „ausgewaschen“ wird (siehe auch: Smog). Um zu verhindern, dass Schwefeldioxid in die Umwelt entweicht, gibt es verschiedene Verfahren zur Rauchgasentschwefelung.
Schweflige Säure und ihre Salze sind Reduktionsmittel, da sie durch Aufnahme eines weiteren Sauerstoffatoms zu Schwefelsäure beziehungsweise Sulfat oxidiert werden. In wäßriger Lösung wird Schweflige Säure durch Luftsauerstoff zu Schwefelsäure oxidiert.[3]
Quellen
- ↑ a b c d e Eintrag zu Schweflige Säure in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 31. März 2007 (JavaScript erforderlich)
- ↑ a b c A.F.Holleman, E.Wiberg. Lehrbuch der Anorganischen Chemie. Walter de Gruyter & Co. Berlin 1995, 101. Auflage, ISBN 3-11-012641-9
- ↑ L. Kolditz, Anorganische Chemie, VEB Deutscher Verlag der Wissenschaften,Berlin 1983, S. 476
Siehe auch
- Schwefelsäure H2SO4 (Dihydrogensulfat)
Weblinks
Wikimedia Foundation.