- HClO3
-
Strukturformel 
Allgemeines Name Chlorsäure Andere Namen Chlor(V)-säure
Summenformel HClO3 CAS-Nummer 7790-93-4 PubChem 19654 Kurzbeschreibung farblose, nur in verdünnter Form existierende Säure Eigenschaften Molare Masse 84,46 g·mol−1 Aggregatzustand nur in wässriger Lösung bis maximal 40 % existent[1]
Dichte Schmelzpunkt Siedepunkt 40 °C (Zersetzung der 18 %-igen Lösung) [1]
pKs-Wert -2,7[2]
Löslichkeit vollständig mischbar mit Wasser
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 

Brand-
förderndÄtzend (O) (C) R- und S-Sätze R: 8-34 S: 17-26-36/37/39-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Chlorsäure ist eine der Sauerstoffsäuren des Chlors (dazu gehören weiterhin Perchlorsäure, Hypochlorige Säure und Chlorige Säure). Chlorsäure ist als Reinstoff nicht beständig und existiert nur in verdünnter Form. Die farblose Lösung findet als starkes Oxidationsmittel Verwendung. Die Salze der Chlorsäure, die Chlorate, besitzen zum Teil große technische Bedeutung.
Inhaltsverzeichnis
Eigenschaften
Physikalische Eigenschaften
Chlorsäure besitzt gemäß dem VSEPR-Modell eine pyramidale Struktur.
Chemische Eigenschaften
Chlorsäure ist eine starke Säure (pKS = ca. −2,7[2]), die in Wasser vollständig in Ionen dissoziiert vorliegt. Umgekehrt besitzen die Chlorationen nur eine geringe Neigung, Protonen anzulagern, so dass sie sich in Wasser mit annähernd neutralem pH-Wert lösen.
Das Chloratom der Chlorsäure besitzt die Oxidationsstufe +V. Es hat als typisches Nichtmetall eine starke Tendenz, in chemischen Reaktionen Elektronen aufzunehmen und in eine niedrigere, stabile Oxidationszahl (−I, 0, +I oder +III) überzugehen. Somit ist Chlorsäure ein starkes Oxidationsmittel mit einem hohen Redoxpotenzial. Allerdings kann Chlorsäure auch zur Perchlorsäure (Oxidationzahl: +VII) aufoxidiert werden. Allgemein steht die Chlorsäure mit anderen Sauerstoffsäuren des Chlors, sowie Chlordioxid und Chlor über Disproptionierungs- und Komproportionierungsreaktionen im Gleichwicht. Die Oxidationswirkung ist im Sauren ausgeprägter als im Alkalischen, was sich in einem höheren Redoxpotenzial äußert. Für die einzelnen Zahlenwerte ergeben sich [3] :
Redox-Paar Oxidationsstufe Normalpotenzial bei pH = 0 Normalpotenzial bei pH = 14 HClO4 /HClO3 (+VII)/(+V) +1,19 V +0,36 V HClO3 /ClO2 (+V)/(+IV) ? ? HClO3 /HClO2 (+V)/(+III) ? ? HClO3 /HClO (+V)/(+I) +1,43 V +0,50 V HClO3 /Cl2 (+V)/(0) +1,47 V +0,48 V HClO3 /Cl- (+V)/(-I) +1,45 V +0,62 V Gewinnung und Darstellung
Die Darstellung von Chlorsäure geht von Chlor aus, das zunächst in Chlorat überführt wird. Die Chlorationen werden anschließend zur Chlorsäure protoniert. Chlor wird zuerst in heiße Natronlauge eingeleitet. Dabei disproportioniert das Chlor in einer Gleichgewichtsreaktion in Chloridionen und Hypochloritionen (1). Anschließend wird die Lösung teilweise angesäuert, so dass ein Anteil der Hypochloritionen in Hypochlorige Säure übergeht (2). Die Hypochlorige Säure kann als starkes Oxidationsmittel Hypochlorite zu Chloraten oxidieren (3). Da im 3. Schritt die Protonen regeneriert werden, müssen beim 2. Schritt nur sehr wenig Protonen zum Ansäuern eingesetzt werden. Die Reaktionsgleichungen für die einzelnen Schritte lauten:
(1)
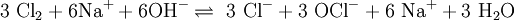
(2)

(3)

Brutto:

Technisch erfolgt die Herstellung von Natriumchlorat durch die Elektrolyse einer wässerigen Kochsalzlösung. Dabei entsteht gasförmiger Wasserstoff und Chlor und Natronlauge. Leitet man das Chlorgas wieder zurück in die Lösung bzw. lässt es gar nicht erst gasförmig entweichen, so kann es in oben geschilderter Weise zu einer Natriumchloratlösung reagieren.
Die Herstellung von Chlorsäure erfolgt durch Ansäuern von Lösungen, die Chlorationen enthalten. Geht man von einer Bariumchloratlösung aus und versetzt sie mit verdünnter Schwefelsäure, so fällt das schwerlösliche Bariumsulfat aus. In Lösung verbleibt nur die Chlorsäure.[4]

Durch wasserentziehende Mittel kann Chlorsäure bis zu einer Konzentration von 40 % aufkonzentriert werden. Höher konzentrierte Lösungen zersetzen sich unter Bildung von Chlor, Chlordioxid und Perchlorsäure:


Verwendung
Eine handelsübliche Mischung von Chlorsäure mit rauchender Salzsäure nennt man Euchlorin (40 % HClO3 + 38 % HCl). Die Kombination aus starken sauren und oxidierenden Eigenschaften kann dem Aufschluss von ansonsten unlöslichen Mineralien und der Zerstörung organischer Stoffe dienen. Dabei geht die Oxidationswirkung nicht nur von der Chlorsäure selbst aus, sondern auch von Chlor und Chlordioxid, die bei der Reaktion mit HCl entstehen:

Sicherheitshinweise
Auch verdünnte Chlorsäure besitzt brandfördernden Charakter und darf nicht mit organischen Materialien in Kontakt gebracht werden.
Einzelnachweise
- ↑ a b c d e Eintrag zu Chlorsäure in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 4.1.2008 (JavaScript erforderlich)
- ↑ a b Nils Wiberg, Egon Wiberg, Arnold Fr. Holleman: Lehrbuch der Anorganischen Chemie. 102 Auflage. de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- ↑ Nils Wiberg, Egon Wiberg, Arnold Fr. Holleman: Lehrbuch der Anorganischen Chemie. 91.-100 Auflage. de Gruyter, Berlin 1985, ISBN 3-11-007511-3, S. 420 (Angegebene Einzelwerte teilweise mit Regel auf S. 227 ebenda (Kleingedrucktes, "Luthersche Regel") berechnet).
- ↑ G. Brauer (Hrsg.): Handbook of Preparative Inorganic Chemistry 2. Ausgabe, Vol. 1, Academic Press 1963, S. 312–313.
Wikimedia Foundation.
