- HMO-Methode
-
Die von Erich Hückel vorgeschlagene Hückel-Näherung, auch: Hückel-Molekülorbital-Modell/Methode (HMO-Modell/Methode), ist eine Methode der semiempirischen Quantenchemie, die mit wenig Rechenaufwand erstaunlich gute Resultate liefert. Sie erlaubt es, Molekülorbitale in konjugierten Systemen zu approximieren. Die beiden wichtigsten Folgerungen sind die Hückel-Regel und die Woodward-Hoffmann-Regeln.
Inhaltsverzeichnis
Anwendung
Die Näherung leitet sich vom Ritz'schen Verfahren ab. Dabei wird formal das Eigenwertproblem
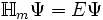 reduziert auf
reduziert auf 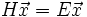 . Im ersten Fall ist Ψ eine Eigenfunktion des Molekül-Hamiltonoperators
. Im ersten Fall ist Ψ eine Eigenfunktion des Molekül-Hamiltonoperators 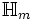 . Um sie genau zu bestimmen müsste bei einem n-atomigen Molekül eine 6n-dimensionale partielle Differentialgleichung gelöst werden, was analytisch nicht möglich ist. Im zweiten Fall ist
. Um sie genau zu bestimmen müsste bei einem n-atomigen Molekül eine 6n-dimensionale partielle Differentialgleichung gelöst werden, was analytisch nicht möglich ist. Im zweiten Fall ist 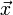 der n-dimensionale Vektor der die Koeffizienten zur Linearkombination enthält.
der n-dimensionale Vektor der die Koeffizienten zur Linearkombination enthält.Nachdem
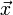 berechnet wurde, kann das Molekülorbital als entsprechende Linearkombination der einzelnen pz-Orbitale angegeben werden. Der Wert E gibt die Energie des Orbitals wieder.
berechnet wurde, kann das Molekülorbital als entsprechende Linearkombination der einzelnen pz-Orbitale angegeben werden. Der Wert E gibt die Energie des Orbitals wieder.Im Ritz'schen Verfahren wird nach der Hartree-Fock Methode iterativ eine möglichst gute Lösung gefunden. Dafür müssen in jedem Schritt eine große Zahl von Integralen gelöst werden, was hohen Rechenaufwand bedeutet. Die Vereinfachung der Hückelnäherung ist, dass alle Integrale parametrisiert werden.
Die n konjugierten Atome im Molekül werden durchnummeriert. Die Matrix H = (hij) ist eine n x n Matrix. Man setzt:
hii = αi
hij = β, falls die beiden Atome benachbart sind (und über Konjugation verknüpft)
hij = 0 sonst
αi ist dabei das Coulombintegral des Atoms i im Molekül (αi<0)
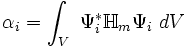
(* ist dabei die komplexe Konjugation, V bezeichnet das ganze Volumen)β das Resonanzintegral zwischen zwei Atomen i,j (wird für alle Atompaare als gleich angenommen) (β<0)
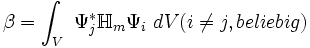
Der Sinn der Näherung ist, dass diese beiden Integrale nicht berechnet werden. Sie können zum Beispiel anhand von empirischen Daten geschätzt werden. Für zwei Atome von derselben Art werden die Coulombintegrale gleichgesetzt. Besonders einfach kann man daher reine Kohlenwasserstoffe berechnen. Es bleiben nur zwei Konstante α und β übrig. Die Eigenvektoren sind unabhängig von deren Wert.
Ableitung der Hückel-Regel
Die Frost-Kreis bietet eine einfache Möglichkeit, die Stabilität cyclisch-konjugierter ebener Moleküle abzuschätzen. Sie basiert auf der überraschenden Tatsache, dass das Energieniveauschema eines cyclisch-konjugierten ebenen n-atomaren Moleküls als regelmäßiges n-Eck dargestellt werden kann.
Die zu einem n-Ring gehörige n x n Matrix wird gebildet, indem man in die Hauptdiagonale α schreibt, links und rechts daneben β und in die links untere und rechts obere Ecke β:
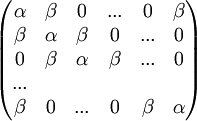
Die Eigenwerte dieser Matrix ergeben sich zu
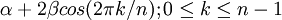 . Trägt man nun die Energie entlang der y-Achse auf, beachtet, dass β negativ ist und hält entsprechende Abstände in x-Richtung ein, so erhält man ein auf der Spitze stehendes n-Eck.
. Trägt man nun die Energie entlang der y-Achse auf, beachtet, dass β negativ ist und hält entsprechende Abstände in x-Richtung ein, so erhält man ein auf der Spitze stehendes n-Eck.Dieses n-Eck kann nun mit einer ungeraden Zahl von Elektronenpaaren (4n+2 π-Elektronen) unter hohem Energiegewinn besetzt werden. Diese Moleküle werden als "Aromaten" bezeichnet. Bei einer geraden Zahl von Elektronenpaaren (4n π-Elektronen) wären die beiden obersten Niveaus halbbesetzt, das Molekül paramagnetisch und der gesamte Energiegewinn gering. Diese Verbindungen sind instabil und heißen "Antiaromaten".
Beispiel
Benzol
Quellen
- Peter W. Atkins: Physikalische Chemie. Weinheim [u.a.] : VCH-Verl.-Ges.
- Dietmar Dorninger: Mathematische Grundlagen für Chemiker. Eisenstadt : Prugg
Wikimedia Foundation.








