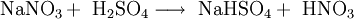- HNO3
-
Strukturformel 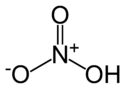
Allgemeines Name Salpetersäure Andere Namen Dioxidohydroxidostickstoff, Scheidewasser, Hydrogennitrat
Summenformel HNO3 CAS-Nummer 7697-37-2 PubChem 944 Kurzbeschreibung farblos (rein), hellgelb bis rötliche Flüssigkeit (je nach gelöstem Stickoxid) Eigenschaften Molare Masse 63,01 g·mol−1[1] Aggregatzustand flüssig
Dichte 1,52 g/ml (20 °C)[1]
Schmelzpunkt −42 °C [1]
Siedepunkt 86 °C [1]
Dampfdruck 56 hPa [1] (20 °C)
pKs-Wert -1.37 [2]
Löslichkeit mit Wasser in jedem Verhältnis mischbar, heftige Reaktion mit Ethanol [1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 

Brand-
förderndÄtzend (O) (C) R- und S-Sätze R: 8-35 S: (1/2)-23-26-36-45 MAK 5,2 mg·m−3 [4]
LD50 430 mg/kg [1] (Mensch)
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Salpetersäure (nach der Nomenklatur der IUPAC Hydrogennitrat genannt) ist die bekannteste und stabilste Sauerstoffsäure des Stickstoffs. Der Name leitet sich vom Salpeter ab, aus dem sie durch Zugabe einer stärkeren Säure (Schwefelsäure) gewonnen werden kann.
Salpetersäure liegt in wässriger Lösung weitgehend dissoziiert vor. Als starke anorganische Säure zählt sie zu den Mineralsäuren. Ihre Salze und Ester heißen Nitrate. Die Salze werden auch mit dem Trivialnamen „-salpeter“ gekennzeichnet, z. B.: Chilesalpeter, (Kali-)Salpeter, Ammonsalpeter, Kalksalpeter oder Mauersalpeter, Barytsalpeter etc.
Die reine Säure ist farblos und hat einen scharf stechenden Geruch. Sie wird unter anderem zur Herstellung von Düngemitteln, Farbstoffen und Sprengstoffen verwendet.
Inhaltsverzeichnis
Geschichte
In der Schrift De inventione veritatis aus dem 12. Jahrhundert wird erwähnt, dass bereits im 9. Jahrhundert der arabische Alchimist Geber rohe Salpetersäure („Aqua dissolutiva“) durch trockenes Erhitzen von Salpeter (lat. sal petrae = Felsensalz; KNO3), Cyprischem Vitriol (CuSO4·5H2O) und Alaun (KAl(SO4)2·12H2O) gewonnen haben soll. Im 13. Jahrhundert soll Albertus Magnus die Salpetersäure benutzt haben, um Gold und Silber zu trennen („Scheidewasser“). Jedoch wurden viele Schriften Albertus Magnus nur zugeschrieben, um ihnen höheres Gewicht zu verleihen, wahrscheinlich auch die über die Verwendung der Salpetersäure. Später wurde Salpeter mit Eisenvitriol (FeSO4 · 7 H2O) erhitzt, was höhere Ausbeuten bei niedrigerer Temperatur lieferte.
J. R. Glauber gewann Mitte des 17. Jahrhunderts reinen spiritus nitri durch Umsetzung und Destillation von Salpeter mit Schwefelsäure, einem bis heute gebräuchlichen Laborverfahren zur Herstellung der Salpetersäure, die im Mittelalter auch aqua fortis oder aqua valens und im englischen Sprachraum strong water genannt wurde. Als Bestandteile der Salpetersäure erkannte A. L. Lavoisier Mitte des 18. Jahrhunderts die chemischen Elemente Stickstoff und Sauerstoff. Die genaue Zusammensetzung wurde von Henry Cavendish bestimmt, dem auch die Synthese aus dem Stickstoff der Luft durch elektrische Entladung gelang.
Eine rationelle Fabrikation begann erst Anfang des 19. Jahrhunderts, als billige Schwefelsäure und Chilesalpeter in ausreichenden Mengen verfügbar waren. Auch die „Luftverbrennung“ in einem elektrischen Lichtbogen wurde zu einem großtechnischen Verfahren entwickelt (Birkeland–Eyde), das jedoch nur in Ländern mit billigem Strom konkurrenzfähig war. Die katalytische Oxidation von Ammoniak über Platin wurde von C. F. Kuhlmann (1838) entdeckt. Bis zur Erfindung der Ammoniaksynthese durch Haber und Bosch blieb jedoch Ammoniak zu teuer im Vergleich zu Chilesalpeter. Zu Beginn des 20. Jahrhunderts entwickelte Wilhelm Ostwald die Herstellung von Salpetersäure aus Ammoniak zur industriellen Reife. Die billige Ammoniak-Oxidation hat heute alle anderen großtechnischen Verfahren verdrängt.
Herstellung
Salpetersäure wird technisch seit 1908 nach dem Ostwaldverfahren hergestellt. Es handelt sich dabei um die katalytische Oxidation von Ammoniak. Das Ammoniak-Luft-Gemisch wird rasch (1/1000 s Berührungszeit) durch heiße Platin-Rhodium-Netze (Katalysator) geleitet. Bei 800 °C entsteht Stickstoffmonoxid, das beim Abkühlen mit überschüssigem Sauerstoff zu Stickstoffdioxid und dann in Rieseltürmen mit Wasser zu etwa 60%iger Salpetersäure reagiert. Die 60%ige Salpetersäure kann durch Destillation bis 68 % konzentriert werden, was dem Azeotrop mit Siedepunktmaximum (122 °C) entspricht. Höhere Konzentrationen lassen sich durch Entwässerung mit Magnesiumnitrat (Mg(NO3)2) oder durch Behandlung von Distickstofftetroxid (N2O4) mit der stöchiometrisch nötigen Menge von Sauerstoff (bzw. Luft) und Wasser erreichen.
Im Labormaßstab kann rauchende Salpetersäure durch Umsetzung konzentrierter Schwefelsäure mit Alkalinitraten dargestellt werden. Vor 1908 wurde Salpetersäure durch dieses Verfahren unter Verwendung von Natriumnitrat (Chilesalpeter) gewonnen.
Oft auftretende Verunreinigungen der Säure mit Halogenen oder Halogenwasserstoffen lassen sich durch Destillation mit etwas Silbernitrat beseitigen. Wasserfreie Salpetersäure erhält man, von einer durch Destillation hochkonzentrierten Säure ausgehend, durch Durchleiten von Inertgas oder Destillation über Phosphorpentoxid oder mit Oleum.[5]
Eigenschaften
Salpetersäure ist in reinem Zustand farblos. Konzentrierte Salpetersäure zersetzt sich jedoch leicht (besonders unter Lichteinwirkung) und hat aufgrund des in ihr gelösten Stickstoffdioxids (NO2) oft einen gelblichen oder rötlichen Farbton. Reine Salpetersäure, die freies Stickstoffdioxid enthält, wird rauchende Salpetersäure genannt. Sie enthält über 90 % HNO3, wirkt stark oxidierend und kann manche leicht brennbaren Stoffe entzünden. Salpetersäure, die durch gelöstes Stickstoffdioxid gelb gefärbt ist, kann durch eine kleine Menge Harnstoff oder besser Harnstoffnitrat entfärbt werden.
Salpetersäure löst die meisten Metalle auf. Ausnahmen sind die Edelmetalle Gold, Platin und Iridium. Auch Aluminium, Titan, Zirconium, Hafnium, Niob, Tantal und Wolfram widerstehen in Folge der Passivierung durch Salpetersäure, wobei sich auf dem Metall eine fest haftende, undurchlässige Oxidschicht bildet. Da man somit Gold und Silber trennen konnte, wurde sie früher Scheidewasser genannt. Gemischt mit Salzsäure (Königswasser) kann sie auch diese Edelmetalle auflösen. Weiter sind Aluminium und Eisen infolge Passivierung resistent gegenüber kalter, Chrom gegenüber heißer Salpetersäure.
Beim Kontakt von Eiweißen, die aromatische Aminosäuren wie L-Phenylalanin oder L-Tyrosin enthalten werden diese von der Salpetersäure unter Nitrierung des Benzolrings gelbgefärbt. Die Reaktion wird Xanthoprotein-Reaktion genannt und kann zum Nachweis aromatischer Aminosäuren bzw. von Eiweißen benutzt werden.
Physikalische Eigenschaften von HNO3/H2O-Mischungen in Abhängigkeit von der Konzentration bei 20 °C und 1,013 bar
Gew % HNO3 0 10 20 30 40 50 60 70 80 90 100 Dichte
(g/cm³)1,00 1,05 1,12 1,18 1,25 1,31 1,37 1,42 1,46 1,48 1,513 Viskosität
(mPa·s)1,00 1,04 1,14 1,32 1,55 1,82 2,02 2,02 1,84 1,47 0,88 Fp (°C) 0 -7 -17 -36 -30 -20 -22 -41 -39 -60 -42 Kp (°C) 100,0 101,2 103,4 107,0 112,0 116,4 120,4 121,6 116,6 102,0 86,0 p(HNO3) (mbar) 0,0 0,0 0,0 0,0 0,0 0,3 1,2 3,9 14,0 36,0 60,0 p(H2O) (mbar) 23,3 22,6 20,2 17,6 14,4 10,5 6,5 3,5 1,2 0,3 0,0 HNO3 (mol/L) 1,7 3,6 5,6 7,9 10,4 13,0 15,8 18,5 21 24,01 Verwendung
Salpetersäure ist einer der wichtigsten Grundstoffe der chemischen Industrie. Sie dient:
- in Form ihrer Salze (Nitrate) als Düngemittel und für Explosivstoffe,
- als Silbernitrat für die Fotoindustrie,
- als Scheidewasser zur Trennung (Quartation) von Gold und Silber (Silber wird aufgelöst)
- in Mischungen mit Salzsäure als Königswasser zum Auflösen von Gold sowie zum Vergolden und zum Nachweisen von Gold
- zum Beizen und Brennen von Metallen (grafische und galvanische Technik),
- zur Nitrierung von organischen Stoffen bei der Herstellung von Farbstoffen, Heilmitteln, Explosivstoffen und Desinfektionsmitteln,
- in Form ihrer Ester zur Herstellung von Explosivstoffen (Sprengöl), Celluloid, Nitro- und Zaponlacke,
- zum Polieren von Metallen.
Gemische mit Schwefelsäure werden Nitriersäure genannt und zur Nitrierung von organischen Verbindungen verwendet.
Sie wurde bis in die späten 1980er Jahre in der Raketentechnik als Oxidator verwendet (z. B. in der Agena-Oberstufe).
Nachweis
Salpetersäure kann mittels Nitratnachweis durch die Ringprobe und durch Lunges Reagenz nachgewiesen werden. Diese Nachweisverfahren werden auch als klassische Verfahren bezeichnet.
Siehe auch
Quellen
- ↑ a b c d e f g Sicherheitsdatenblatt (Merck) (die Angaben gelten für 100-prozentige Salpetersäure)
- ↑ pKs Tabelle CCI ETH
- ↑ Eintrag zu CAS-Nr. 7697-37-2 im European chemical Substances Information System ESIS
- ↑ Eintrag zu CAS-Nr. 7697-37-2 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 30. März 2008 (JavaScript erforderlich)
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 491-2.
Wikimedia Foundation.