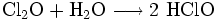- HOCl
-
Strukturformel 
Allgemeines Name Hypochlorige Säure Andere Namen Unterchlorige Säure
Summenformel HOCl CAS-Nummer 7790-92-3 PubChem 24341 Kurzbeschreibung schwach grüngelb gefärbte, chlorkalkartig riechende, nur schwach dissoziierte Säure Eigenschaften Molare Masse 52,46 g·mol−1 Aggregatzustand flüssig
pKs-Wert 7,54[1]
Löslichkeit löslich in Wasser
Sicherheitshinweise Gefahrstoffkennzeichnung [2] [3] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Hypochlorige Säure (veraltet Unterchlorige Säure) HOCl, ist eine schwach grüngelb gefärbte, chlorkalkartig riechende, nur schwach dissoziierte Säure. Sie wirkt bleichend und oxidierend.
Inhaltsverzeichnis
Gewinnung und Darstellung
Sie wird durch Einleiten von Chlorgas in Wasser und gleichzeitiger Beseitigung der entstehenden Salzsäure durch Quecksilberoxid hergestellt. Sie kann ebenfalls durch Oxidation von Salzsäure mit Wasserstoffperoxid und einem Katalysator hergestellt werden. Dabei entsteht zunächst Chlorgas, welches sich in Wasser zu hypochloriger Säure und Salzsäure zersetzt. Die Salzsäure wird anschließend wieder zu Chlorgas aufoxidiert und der Vorgang wiederholt sich.
Zuletzt kann chlorfreie hypochlorige Säure durch Reaktion von Dichloroxid mit Wasser hergestellt werden.[4]
Eigenschaften
Die Säure ist unbeständig und nur in wässriger Lösung herstellbar. Selbst in geringen Konzentrationen neigt sie zur Disproportionierung zu Chlorsäure und Salzsäure.
Die Salze und Ester der hypochlorigen Säure heißen Hypochlorite.
Verwendung
Desinfektion von Badewasser in Schwimmbädern, zum Beispiel bei der Langzeitchlorung mit Trichlorisocyanursäuretabletten (TCCS), welche langsam mit dem Beckenwasser zu Cyanursäure und hypochloriger Säure reagieren. In seltenen Fällen wird hypochlorige Säure auch zur Trinkwasseraufbereitung eingesetzt.
Sicherheitshinweise
Hypochlorige Säure ist zwar eine sehr schwache Säure, kann allerdings durch ihre starke Oxidationswirkung dennoch Reizungen der Haut und sogar Verätzungen verursachen. Bei ihrem Zerfall entstehen stark ätzende Stoffe, wie Chlorsäure und Salzsäure, die organisches Gewebe innerhalb kürzester Zeit gänzlich abtöten oder sogar vollkommen zerfressen können. Zu beachten ist, dass hypochlorige Säure niemals zur Oxidation von Alkoholen eingesetzt werden darf, da sie mit ihnen durch Veresterung hochexplosive Hypochlorite (z. B. Alkylhypochlorit) bilden kann. Mit Ammoniak bildet sich die explosive Stickstoffwasserstoffsäure.
Quellen
- ↑ Holleman/Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, Berlin 2007. ISBN 978-3-11-017770-1
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Eintrag zu CAS-Nr. 7790-92-3 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 21. August 2007 (JavaScript erforderlich)
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 308-9.
-
Wikimedia Foundation.