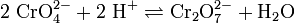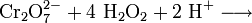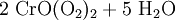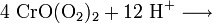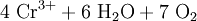- Hartverchromung
-
Eigenschaften Allgemein Name, Symbol, Ordnungszahl Chrom, Cr, 24 Serie Übergangsmetalle Gruppe, Periode, Block 6, 4, d Aussehen silbrig metallisch CAS-Nummer 7440-47-3 Massenanteil an der Erdhülle 1,9 · 10−2 % Atomar Atommasse 51,9961 u Atomradius (berechnet) 140 (166) pm Kovalenter Radius 127 pm Elektronenkonfiguration [Ar] 3d54s1 Elektronen pro Energieniveau 2, 8, 13, 1 Austrittsarbeit 4,60 eV 1. Ionisierungsenergie 652,9 kJ/mol 2. Ionisierungsenergie 1590,9 kJ/mol 3. Ionisierungsenergie 2987 kJ/mol 4. Ionisierungsenergie 4743 kJ/mol 5. Ionisierungsenergie 6702 kJ/mol 6. Ionisierungsenergie 8744,9 kJ/mol Physikalisch Aggregatzustand fest Kristallstruktur kubisch raumzentriert Dichte 7,14 g/cm3[1] Mohshärte 8,5 Magnetismus antiferromagnetisch Schmelzpunkt 2130 K (1857 °C) Siedepunkt 2945 K (2672 °C) Molares Volumen 7,23 · 10−6 m3/mol Verdampfungswärme 344,3 kJ/mol Schmelzwärme 16,9 kJ/mol Dampfdruck 990 Pa bei 2130 K Schallgeschwindigkeit 5940 m/s bei 293,15 K Spezifische Wärmekapazität 450 J/(kg · K) Elektrische Leitfähigkeit 7,74 · 106 A/(V · m) Wärmeleitfähigkeit 93,7 W/(m · K) Chemisch Oxidationszustände 6, 3, 2 Oxide (Basizität) - (stark sauer) Normalpotential Elektronegativität 1,66 (Pauling-Skala) Isotope Isotop NH t1/2 ZM ZE MeV ZP 48Cr 21,58 h ε 1,659 48V 49Cr {syn.} %
42,3 min ε 2,631 49V 50Cr 4,345 %
>1,8 · 1017 a 2 εε 1,037 50Ti 51Cr 27,7025 d ε 0,753 51V 52Cr 83,789 %
Stabil 53Cr 9,501 %
Stabil 54Cr 2,365 %
Stabil 55Cr 3,497 min β− 2,603 55Mn 56Cr 5,94 min β− 1,617 56Mn NMR-Eigenschaften Sicherheitshinweise Gefahrstoffkennzeichnung [2] Pulver


Leicht-
entzündlichGesundheits-
schädlich(F) (Xn) R- und S-Sätze R: 11-40 (Pulver) S: 7-33-36/37-60(Pulver) Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet.
Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen.Chrom (von griech. chroma „Farbe“) ist ein chemisches Element im Periodensystem der Elemente mit dem Symbol Cr und der Ordnungszahl 24. Die Verbindungen von Chrom haben viele verschiedene Farben und werden oft als Pigmente in Farben und Lacken verwendet.
Inhaltsverzeichnis
Geschichte
1761 entdeckte Johann Gottlob Lehmann ein orangerotes Bleichromat-Mineral (PbCrO4) im Ural, das er Rotbleierz nannte. Da er es als eine Blei-Eisen-Selen-Verbindung identifizierte, blieb Chrom noch unentdeckt.
1770 fand Peter Simon Pallas an gleicher Stelle ein rotes Bleimineral, das wegen seiner Rotfärbung Krokoit (von griech. krokos „safranfarben“) genannt wurde. Die Verwendung von Rotbleierz als Farbpigment nahm schnell zu. Ein aus Krokoit gewonnenes strahlendes Gelb, das Chromgelb, wurde als Postgelb zur Modefarbe.
1797 gewann Louis-Nicolas Vauquelin Chrom(III)-oxid Cr2O3 aus Krokoit und Salzsäure. 1798 erhielt er verunreinigtes elementares Chrom durch Reduktion von Chrom(III)-oxid mit Holzkohle. Dieses neu isolierte Element erhielt den Namen Chrom (von griech. chroma „Farbe“), aufgrund der Vielfarbigkeit seiner Salze in unterschiedlichen Oxidationsstufen.
Spuren des neuen Elementes konnte Vauquelin auch in Edelsteinen wie Rubin und Smaragd nachweisen.
Im 19. Jahrhundert wurden Chromverbindungen überwiegend als Farbpigmente und in der Chromgerberei verwandt. Ende des 20. Jahrhunderts werden Chrom und Chromverbindungen hauptsächlich zur Herstellung von korrosions- und hitzebeständigen Legierungen eingesetzt (Verchromen, Chromstahl).
Vorkommen
Chrom wird fast nur als Chromit (Chromeisenstein) FeCr2O4 im Tagebau oder in geringer Tiefe abgebaut. Metallisches Chrom wird durch Reduktion des Erzes mit Aluminium oder Silicium gewonnen.
2003 förderte Südafrika 50 % des Weltbedarfs an Chromit. Andere nennenswerte Förderländer sind Kasachstan (15,2 %), Indien (12,1 %), Simbabwe (3,7 %) und Finnland (3 %). 2006 förderte laut ICDA Südafrika 36 %, Indien 19 %, Kasachstan 17 % und Brasilien, Simbabwe, Türkei und Finnland zusammen 13 %.
Im Jahr 2000 wurden ungefähr 15 Millionen Tonnen marktfähiges Chromiterz gefördert. Hieraus ließen sich 4 Millionen Tonnen Ferrochrom mit einem Marktwert von 2,5 Milliarden Dollar gewinnen. Metallisches Chrom kommt in Lagerstätten sehr selten vor. In der Udatschnaja-Mine in Russland wird eine diamantenhaltige Kimberlit-„Pipe“ ausgebeutet. In der reduzierenden Matrix bildeten sich Diamanten und metallisches Chrom.
Gewinnung und Darstellung
Das geförderte Chromiterz wird vom tauben Gestein befreit. Im zweiten Schritt erfolgt ein oxidierender Aufschluss bei ca. 1200 °C zum Chromat:
Das Natriumchromat wird mit heißem Wasser extrahiert und mit Schwefelsäure ins Dichromat überführt:
Das Natriumdichromat kristallisiert beim Abkühlen als Dihydrat aus der Lösung. Durch eine nachfolgende Reduktion mit Kohle erhält man Chrom(III)-oxid:
Im Anschluss erfolgt die aluminothermische Reduktion des Chrom(III)-oxids zu Chrom:
Chrom kann nicht durch Reduktion mit Kohle aus den oxidischen Erzen gewonnen werden, da hierbei Chromcarbid entsteht. Reineres Chrom wird durch elektrolytische Abscheidung des Cr3+-Ions aus schwefelsaurer Lösung dargestellt. Entsprechende Lösungen werden durch Auflösen von Chrom(III)-oxid oder Ferrochrom in Schwefelsäure hergestellt. Ferrochrom als Ausgangsstoff erfordert allerdings eine vorherige Abtrennung des Eisens.
Extrem reines Chrom wird durch weitere Reinigungsschritte nach dem van-Arkel-de-Boer-Verfahren erzeugt.
Ferrochrom wird durch Reduktion von Chromit im Lichtbogenofen bei 2800 °C erzeugt.
Eigenschaften
Chrom ist ein silberweißes, korrosions- und anlaufbeständiges hartes Metall, das im Urzustand zäh, form- und schmiedbar ist. Es ist antiferromagnetisch mit einer Néel-Temperatur von 475 K[1].
Häufige Oxidationsstufen des Chroms sind +2, +3 und +6, wobei +3 die beständigste ist.
Cr(II) ist mit d4-Konfiguration instabil. Es gibt wohl kaum ein Reduktionsmittel, das so schnell Sauerstoff aus der Luft aufnimmt wie Cr(II). Aber auch ohne Luftzutritt sind Cr2+-Lösungen nur dann kurze Zeit stabil, wenn sie aus reinstem Chrom (z. B. Elektrolytchrom) gewonnen werden.
Cr3+ ist die stabilste Form. Dies wird durch die Kristallfeldtheorie erklärt, nach der die d3 Konfiguration durch eine halbgefüllte Unterschale stabilisiert ist.
Cr(VI) als Chromat (CrO42−) bzw. Dichromat (Cr2O72−) wird als starkes Oxidationsmittel eingesetzt. Es ist giftig und karzinogen. In wässrigen Lösungen liegt zwischen den beiden Ionen ein chemisches Gleichgewicht vor, das pH-abhängig ist. Säuert man eine verdünnte gelbe Chromat-Lösung an, gibt man also H+-Ionen dazu, so verschiebt sich nach LeChatelier das Gleichgewicht in Richtung des Dichromates, die Lösung färbt sich orange.
Nachweise
_chloride_green_hexahydrate.jpg) Grünes Chrom(III)-chlorid: Im Alkalischen Bad wird das zur Ammoniumsulfidgruppe gehörende dreiwertige, grüne Chrom zum gelben Chromat oxidiert (Redoxreaktion)
Grünes Chrom(III)-chlorid: Im Alkalischen Bad wird das zur Ammoniumsulfidgruppe gehörende dreiwertige, grüne Chrom zum gelben Chromat oxidiert (Redoxreaktion)Chrom(III)-salze ergeben im Kationentrenngang bei der Nachweisreaktion mit dem „Alkalischen Bad“ (Ätznatron in konz. Wasserstoffperoxidlösung) gelbe Chromatlösungen, die im Sauren zu orangem Dichromat reagieren:
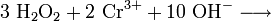
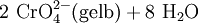
- (Achtung: Chromate und Dichromate sind krebserregend, giftig! Entgiftung durch Zugabe von Säure und Metall, wobei durch Einwirkung des Reduktionsmittels naszierender Wasserstoff wieder grüne Chrom(III)-ionen entstehen).
Ein charakteristischer Nachweis für Cr(VI) ist die Bildung von blauem Chrom(VI)-peroxid, CrO(O2)2 (Oftmals auch als CrO5 beschrieben). Hierzu wird die Lösung mit Salpetersäure (HNO3) angesäuert und mit einem Ether oder Amylalkohol überschichtet und mit wenigen Tropfen Wasserstoffperoxid (H2O2) versetzt und geschüttelt. Eine Blaufärbung des Ethers zeigt Chrom(VI)-peroxid an. Der Ether dient hier nur als Stabilisator, da sich das Chromperoxid sonst nach einiger Zeit unter Sauerstoffentwicklung wieder zersetzt.
Zersetzung:
Auch bei den Vorproben tritt beim Schmelzen der Salzperle mit Phosphorsalz NaNH4HPO4 oder Borax (Dinatriumtetraborat) Na2B4O7 tritt eine charakteristische Färbung mit Schwermetallsalzen auf (mit Cr3+ grün). Bei der Oxidationsschmelze mit Soda und Salpeter hingegen wird Chrom(III) zu Chromat oxidiert (Gelbfärbung).
Quantitativ kann Chrom(VI) mittels Iodometrie erfasst werden, wobei die grüne Farbe des entstehenden Chrom(III)-aquakomplexes die visuelle Erkennung des Äquivalenzpunktes erschwert. Spuren von Chromverbindungen können durch Methoden der Atomspektrometrie bestimmt werden. Dabei sind als Nachweisgrenze 2 µg/l für die Flammen-AAS und 0,02 µg/l für die Graphitrohr-AAS angegeben worden.[3] In der Polarografie ergibt Dichromat in 1 M Kaliumchloridlösung mehrere Stufen bei -0,28, -0.96, -1,50 und - 1,70 V (gegen SCE). Dreiwertiges Chrom (als Hexamminkomplex) ergibt in einem 1 M Ammoniak-Ammoniumchlorid-Puffer eine Stufe bei -1,42 V.[4]
Sicherheitshinweise
Metallisches Chrom und Chrom(III)-Verbindungen sind gewöhnlich nicht gesundheitsschädigend. Oral aufgenommene Chrom(VI)-Verbindungen sind im Gegensatz dazu als äußerst giftig einzustufen. Die letale Dosis entspricht einem halben Teelöffel. Chrom(VI)-Verbindungen sind seit langem als krebserregend bekannt. Sie werden unter anderem in Kühlsystemen als Korrosionsschutzmittel verwendet. Die meisten Chrom(VI)-Verbindungen verursachen Irritationen an Augen, Haut und Schleimhäuten. Chronischer Kontakt mit Chrom(VI)-Verbindungen kann bei unterlassener Behandlung zu bleibenden Augenschäden führen.
1958 empfahl die WHO (World Health Organization) für Chrom(VI)-Verbindungen eine maximal zulässige Konzentration von 0,05 mg/Liter im Trinkwasser. Auch nachfolgende Untersuchungen führten zu keiner Anpassung dieser Empfehlung.
Chrom(VI) ist seit 2006 in der Elektroindustrie (EU-Richtlinie über Elektrogeräte) und seit 2007 in der Automobilindustrie (Richtlinie 2000/53/EG über Altfahrzeuge) verboten.
Physiologische Bedeutung
Das Element Chrom hat in seiner elementaren Form keine physiologische Bedeutung im menschlichen Körper.
Die Rolle von Cr(III) (Cr3+-Ionen) im menschlichen Körper wird zur Zeit kontrovers diskutiert. Es gibt Hinweise darauf, dass Cr(III) eine Bedeutung im Kohlenhydrat- und Fettstoffwechsel von Säugetieren haben könnte. Diesen Hinweisen wird zur Zeit nachgegangen. Frühere Hinweise, dass das beliebte Nahrungsergänzungsmittel Cr(III)-picolinat einen günstigen Einfluss auf den Körperaufbau hat konnten in späteren Studien nicht bestätigt werden. In einer Studie mit Hamsterzellen konnte gezeigt werden, dass Cr(III)-picolinat mutagen ist und Krebs auslösen kann.
Die aktuell zur Verfügung stehenden Daten weisen darauf hin, dass es extrem unwahrscheinlich ist, eine Chromunterversorgung zu erleiden. Einen toxischen Effekt lösen auch höhere Dosen Cr(III) nur schwer aus, da das Löslichkeitsprodukt von Cr(III)-hydroxid extrem niedrig ist (6,7 · 10−31). Es wird deshalb im menschlichen Darm vermutlich nur sehr schwer aufgenommen. In den USA wurde die empfohlene Aufnahmemenge Cr(III) von 50–200 µg/Tag auf 35 µg/Tag bei erwachsenen Männern und auf 25 µg/Tag bei erwachsenen Frauen heruntergesetzt.
Cr(VI)-Verbindungen sind äußerst giftig. Sie sind mutagen und schädigen die DNA. Sie gelangen über die Atemwege in den Körper und schädigen das Lungengewebe. Menschen, die chronisch solchen Verbindungen ausgesetzt sind, haben ein erhöhtes Risiko für Lungenkrebs. Die giftige Wirkung steigt dabei mit der Unlöslichkeit des Salzes.[5]
Verwendung
Chrom und Chromverbindungen werden für die verschiedene Anwendungen eingesetzt, in denen seine Beständigkeit genutzt wird.:
- Hartverchromung: galvanisches Aufbringen einer bis zu 1 mm dicken Verschleißschutzschicht direkt auf Stahl, Gusseisen, Kupfer. Auch Aluminium kann nach dem Aufbringen einer Zwischenschicht verchromt werden (Hartverchromte Aluminiumzylinder im Motorenbau).
- Dekorverchromung: galvanisches Aufbringen einer < 1 μm dicken Cr-Schicht als Dekor mit einer korrosionsschützenden Zwischenschicht aus Nickel oder Nickel-Kupfer. Sehr oft werden auch Kunststoffteile verchromt. Ein Ersatz für die Dekorverchromung ist das Achrolyte-Verfahren.
- Passivierung von galvanischen Zinkschichten (Chromatierung)
- Legierungselement: in korrosions- und hitzebeständigen nichtrostenden Stählen und NE-Legierungen
- Katalysator: um chemische Reaktionen zu ermöglichen oder zu beschleunigen
- Chromgerbung: das wichtigste Verfahren zur Herstellung von Leder
Verbindungen und ihre Verwendung
Chromoxidgrün, Chrom(III)-oxid Cr2O3, wird als Emaillefarbe und zum Glasfärben (grüne Flaschen) verwendet (auch Kölner Brückengrün). Dieses ist nicht mit dem giftigen Chromgrün zu verwechseln.
Chromgelb, Blei(II)-chromat PbCrO4, diente früher als brillant gelbes Farbpigment („Postgelb“). Auf Grund seiner Toxizität wird es heute fast vollständig durch organische Farbpigmente ersetzt. In der Analytik wird es zur iodometrischen Bestimmung von Blei genutzt. Das Chromgelb, das als Künstlerfarbe Anwendung findet, ist je nach Herstellung ein Bleisulfat/Bleichromat (etwa 2 PbSO4 · PbCrO4). Das Pigment wurde 1809 von Vauquelin entdeckt und seit 1820 kommerziell in Deutschland hergestellt. Chromgelb hat ein hohes Deckvermögen, seine Lichtstabilität hängt von dem Gelbton ab. Chromgelb wird kaum in der Ölmalerei verwendet. Vincent van Gogh allerdings verwendete Chromgelb u. a. in den berühmten Sonnenblumenbildern, die in Öl auf Leinwand ausgeführt sind. Diese leiden jedoch heute teilweise unter einer Verfärbung der Gelbtöne, die durch den Zerfall des Pigments Chromgelb zu Bleisulfid verursacht wird.
Der Kunsttechnologe Prof. Christoph Krekel von der Kunstakademie Stuttgart zu der Verwendung des Pigments Chromgelb: „Die Maler haben sich auf das Chromgelb gestürzt, weil es ein sehr brillantes Gelb ist – es hat eine große Farbintensität, das heißt, man konnte mit Hilfe dieses neuen gelben Farbtons eine sehr viel leuchtstärkere Malerei herstellen“.
Chromgelb ist auch eine wichtige Farbe bei der Fälschungsanalyse „alter“ Gemälde.
Chromdioxid, Chrom(IV)-oxid CrO2, ist ein schwarzes ferromagnetisches Pulver zur Herstellung von Magnetbändern mit einem besseren Signal-Rausch-Verhältnis als konventionelle Eisenoxid-Magnetbänder, da Chromdioxid eine höhere Koerzivität besitzt.
Chromsäure mit der hypothetischen Struktur H2CrO4 existiert nur in verdünnter wässriger Lösung. Sie ist sehr giftig. Als Anion existiert sie in einigen Chromaten und Dichromaten.
Das Anhydrid der Chromsäure, das sehr giftige Chrom(VI)-oxid CrO3, wird als Chromtrioxid bezeichnet.
Das orangefarbene, sehr giftige Kaliumdichromat K2Cr2O7 ist ein kräftiges Oxidationsmittel: In schwefelsaurer Lösung werden primäre Alkohole leicht in die betreffenden Aldehyde umgewandelt, was man zum halbquantitativen Nachweis von Alkohol in der Atemluft nutzen kann. Im Laborbereich wurde es in Form von Chromschwefelsäure zur Reinigung von Glasgeräten verwendet. Beim Kontakt mit Chloridionen wird jedoch das flüchtige, krebserregende Chromylchlorid CrO2Cl2 gebildet (Abzug!). Kaliumdichromat wird außerdem als Titrationsmittel verwendet sowie als Fixiermittel in industriellen Färbebädern. Kaliumdichromat und das ebenfalls sehr giftige Ammoniumdichromat (NH4)2Cr2O7 sind die lichtempfindliche Substanz in Chromgelatineschichten der frühen Fotografie (siehe Edeldruckverfahren).
Chromit (Chromeisenstein; siehe oben) FeCr2O4 wird zur Herstellung von Formen für das Brennen von Ziegelsteinen verwendet.
Trivia
Der Film „Erin Brockovich“ setzt sich mit verschwiegener Cr(VI)-Belastung im Trinkwasser auseinander.
Literatur
- A. Pollack: Zwanzig Jahre Verchromung, in: Chemiker-Zeitung 1943, 67, 279–280.
- R. Schliebs: Die technische Chemie des Chroms, in: Chemie in unserer Zeit 1980, 14, 13–17; doi:10.1002/ciuz.19800140103.
- J. B. Vincent: Recent advances in the nutritional biochemistry of trivalent chromium, in: Proceedings of the Nutrition Society 2004, 63, 41–47.
- Harry H. Binder: Lexikon der chemischen Elemente - das Periodensystem in Fakten, Zahlen und Daten. Hirzel, Stuttgart 1999, ISBN 3-7776-0736-3.
- Nikolai P. Lyakišev, Mikhail I. Gasik: Metallurgy of chromium. Allerton Press, New York 1998, ISBN 0-89864-083-0.
Einzelnachweise
- ↑ a b Holleman-Wiberg: Lehrbuch der Anorganischen Chemie
- ↑ Sicherheitsdatenblatt (alfa-aesar) (in kompakter Form: nur Xn, R:40, S:36/37)
- ↑ K. Cammann (Hrsg.), Instrumentelle Analytische Chemie, Spektrum Akademischer Verlag, Heidelberg-Berlin, 2001, S. 4-47.
- ↑ J. Heyrovský, J. Kůta, Grundlagen der Polarographie, Akademie-Verlag, Berlin, 1965, S. 509.
- ↑ Emanuel Rubin, David Strayer: Enviromental and Nutrional Pathology in Raphael Rubin, David Strayer: Rubin's Pathology, Philadelphia, 2008, S. 268.
Weblinks
- Mineralienatlas:Chrom (Wiki)
- ChemGlobe – Chrom Datenblatt
- Katalyse-Institut für angewandte Umweltforschung – Schwermetall Chrom
- WebElements.com – Chromium (engl.)
- EnvironmentalChemistry.com – Chromium (engl.)
- Informationen über Chrom, seine Verbindungen, Vorkommen, etc. (Diplomarbeit, pdf)
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga As Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Te I Xe Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Rn Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Uub Uut Uuq Uup Uuh Uus Uuo
Alkalimetalle Erdalkalimetalle Lanthanoide Actinoide Übergangsmetalle Metalle Halbmetalle Nichtmetalle Halogene Edelgase
Wikimedia Foundation.


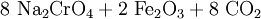
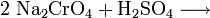
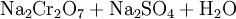
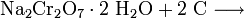
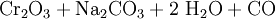
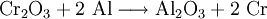
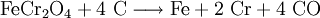

-oxid.jpg)