- 2,3,7,8-Tetrachlordibenzo-1,4-dioxin
-
Strukturformel 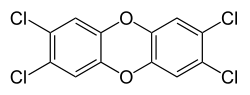
Allgemeines Name 2,3,7,8-Tetrachlordibenzodioxin Andere Namen - 2,3,7,8-Tetrachlordibenzo-p-dioxin
- Dioxin
- TCDD
- Seveso-Gift
Summenformel C12H4O2Cl4 CAS-Nummer 1746-01-6 PubChem 15625 Kurzbeschreibung wasserunlösliche, farblose Kristalle Eigenschaften Molare Masse 321,97 g·mol−1 Aggregatzustand fest
Dichte 1,83 g·cm−3 [1]
Schmelzpunkt Löslichkeit gut in Fetten, schlecht in Ethanol und anderen halbpolaren Lösungsmitteln, unlöslich in Wasser
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
unbekannt R- und S-Sätze R: ? S: ? MAK 0,01 ng·m−3 [1]
LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. 2,3,7,8-Tetrachlordibenzodioxin ist eine chlorhaltige organische Verbindung. Der systematische Name lautet 2,3,7,8-Tetrachlordibenzo-p-dioxin bzw. 2,3,7,8-Tetrachlordibenzo-1,4-dioxin (gesprochen zwei- drei- sieben- acht- tetrachlor- dibenzo- para- di-oxin). Die Substanz leitet sich vom Dibenzodioxin ab und wird abgekürzt als 2,3,7,8-TCDD oder nur TCDD, umgangssprachlich häufig auch als „Dioxin“ oder „Seveso-Dioxin“/„Seveso-Gift“ bezeichnet.
Inhaltsverzeichnis
Geschichte
TCDD wurde erstmals 1957[3] von Wilhelm Sandermann[4] unter Laborbedingungen synthetisiert. Er entdeckte auch die Wirkung von TCDD.
Im Vietnamkrieg wurde von 1967 bis 1975 das Entlaubungsmittel Agent Orange eingesetzt, dessen Verunreinigung mit TCDD zu schweren, bis heute andauernden Schädigungen bei Bevölkerung und US-Soldaten führte.
Am 10. Juli 1976 kam es zu dem verheerenden Sevesounglück, bei dem in der norditalienischen Stadt Seveso zwischen einigen hundert Gramm und wenigen Kilogramm an TCDD austraten.[5]
Im Laufe der Präsidentschaftswahlen in der Ukraine 2004 bestätigte sich der Verdacht auf eine Dioxinvergiftung des Kandidaten Wiktor Juschtschenko, als seine Ärzte in seinem Blut und Gewebe das 6000-fache der normalen Konzentration an TCDD fanden. Juschtschenkos Gesicht zeigt seit dem mutmaßlichen Anschlag starke Chlorakne-Symptome.
Vorkommen
TCDD entsteht zusammen mit anderen polychlorierten Dibenzodioxinen und Dibenzofuranen als Nebenprodukt bei der Synthese von organischen Chlorverbindungen (beispielsweise Halogenphenoxycarbonsäure-Herbizide) oder der Verbrennung von chlor- und kohlenwasserstoffhaltigen Verbindungen.
Unter anderem entsteht es in Müllverbrennungsanlagen im Beisein chlorhaltiger Verbindungen wie PVC. Moderne Verbrennungsanlagen führen daher eine Nacherhitzung auf über 1200 °C mit anschließender schneller Abkühlung durch, wodurch die TCDD-Konzentration auf Bruchteile reduziert wird.
Eigenschaften
2,3,7,8-Tetrachlordibenzodioxin ist ein langlebiger, sehr giftiger Schadstoff, der bei Raumtemperatur in kristalliner Form vorliegt. Außerdem ist er gut in organischen Lösungsmitteln löslich und lipophil.[6] Der logarithmierte Oktanol-Wasser-Verteilungskoeffizient log KOW von TCDD beträgt 6,80.[7]
Verwendung
TCDD ist wie alle anderen Dioxine und Furane ein unerwünschtes Nebenprodukt ohne wirtschaftlichen Nutzen. Es gibt derzeit keine kommerzielle Verwendung für diese Stoffgruppe.
In der tierexperimentellen Forschung wird es als Agonist für den Ah-Rezeptor eingesetzt.
Wirkungsweise
TCDD ist unter den bekannten künstlich erzeugten Stoffen der giftigste, gemessen an der letalen Dosis. Es ist ein Zellgift, das erbgutschädigend und krebserzeugend ist. Kontakt führt zu Chlorakne, schweren Organschäden, neben der Haut insbesondere der Leber, Erbgutschäden unter anderem Missbildungen beim Nachwuchs (teratogen), Krebs. Ob TCDD dabei direkt kanzerogen wirkt, oder als Tumorpromotor fungiert, ist nicht abschließend geklärt.
Die Giftwirkung des TCDD wird nach heutigem Kenntnisstand über Aktivierung des Ah-Rezeptors vermittelt, der – ähnlich wie die Rezeptoren für Steroidhormone und Schilddrüsenhormone – an bestimmte regulatorische DNA-Sequenzen binden kann und dadurch die Expression verschiedener Gene reguliert. Über natürliche Liganden des Ah-Rezeptors ist bisher wenig bekannt. Die TCDD-vermittelte Aktivierung des Ah-Rezeptors führt unter anderem zu einer starken Induktion des Cytochrom P450.
Quellen
- ↑ a b c d Eintrag zu 2,3,7,8-Tetrachlordibenzodioxin in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 19. Dezember 2008 (JavaScript erforderlich)
- ↑ a b 2,3,7,8-Tetrachlordibenzodioxin bei ChemIDplus
- ↑ Wilhelm Sandermann (1984): Dioxin. Die Entdeckungsgeschichte des 2,3,7,8-Tetrachlordibenzo-p-dioxins (TCDD, Dioxin, Sevesogift)
- ↑ Biografie von Wilhelm Sandermann
- ↑ Seveso – 30 Years After: A chronology of events
- ↑ Ottfried Strubelt: Gifte in Natur und Umwelt. Pestizide und Schwermetalle, Arzneimittel und Drogen. Spektrum Akademischer Verlag, Heidelberg, Berlin, Oxford – 1996, S. 183–192.
- ↑ Rene P. Schwarzenbach, Philip M. Gschwend, Dieter M. Imboden: Environmental Organic Chemistry. Wiley-Interscience, Hoboken, New Jersey 2003, ISBN 0-471-35750-2.
Wikimedia Foundation.
