- 2,3-Diphosphoglyceratmutase
-
Bisphosphoglyceratmutase —
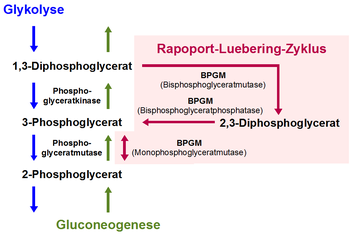
Vorhandene Strukturdaten: s. UniProt Größe 258 Aminosäuren Struktur Homodimer Bezeichner Gen-Name BPGM Externe IDs OMIM: 222800 UniProt: P07783 Enzymklassifikationen EC, Kategorie 5.4.2.4 Phosphotransferase Reaktionsart Umlagerung Substrat 1,3-Diphosphoglycerat Produkte 2,3-Diphosphoglycerat EC, Kategorie 5.4.2.1 Phosphotransferase Reaktionsart Umlagerung Substrat 2-Phosphoglycerat Produkte 3-Phosphoglycerat EC, Kategorie 3.1.3.13 Phosphatase Reaktionsart Hydrolyse Substrat 2,3-Diphosphoglycerat + H2O Produkte 3-Phosphoglycerat + Phosphat Die Bisphosphoglyceratmutase (BPGM) beziehungsweise 2,3-Diphosphoglyceratmutase ist ein Enzym, das vor allem in den Erythrozyten (roten Blutkörperchen) und in erythropoetischem Gewebe von Säugetieren vorkommt. Sie ist in den roten Blutkörperchen das zentrale Enzym des Rapoport-Luebering-Zyklus, einem Nebenweg der Glykolyse, in welchem sie als trifunktionales Enzym drei verschiedene biochemische Reaktionen zur Bildung und zum Abbau von 2,3-Diphosphoglycerat (2,3-DPG) katalysiert. 2,3-DPG ist als biochemischer Effektor an der Regulation der Bindungfähigkeit (Affinität) des Blutfarbstoffs Hämoglobin für das Atemgas Sauerstoff in den Erythrozyten beteiligt.
Inhaltsverzeichnis
Eigenschaften und Funktion
Die Bisphosphoglyceratmutase katalysiert zum einen als Synthase (2,3-DPG-Synthase, synonym Bisphosphoglyceratmutase; EC 5.4.2.4) die Bildung von 2,3-Diphosphoglycerat (2,3-DPG) aus dem in der Glykolyse entstehenden 1,3-Diphosphoglycerat (1,3-DPG). Darüber hinaus fungiert sie auch als Phosphatase (2,3-Bisphosphoglyceratphosphatase; EC 3.1.3.13) für die Umsetzung des 2,3-DPG zu 3-Phosphoglycerat (3-PG) und als Mutase (Monophosphoglyceratmutase; EC 5.4.2.1) für die die Gleichgewichtsreaktion zwischen den Phosphoglycerinsäure-Verbindungen 3-PG und 2-Phosphoglycerat (2-PG).[1][2]
Die BPGM besitzt für die drei verschiedenen Funktionen ein gemeinsames aktives Zentrum, das mit zwei unterschiedlichen Bindungsstellen für Di- beziehungsweise Monophosphoglycerate ausgestattet ist.[3] Die wichtigste Aktivität des Enzyms ist die irreversibel verlaufende Synthasereaktion, wodurch sie sich von der Phosphoglyceratmutase im Hauptweg der Glykolyse unterscheidet. Diese ähnelt der BPGM hinsichtlich der Molekülmasse, der Untereinheitenstruktur sowie der Aminosäuresequenz und fungiert ebenfalls als trifunktionales Enzym, allerdings mit einem anderem Verhältnis der drei Aktivitäten zueinander.[4]
Die stofflich neutrale Umlagerung vom 1,3-DPG zum 2,3-DPG setzt das Vorhandensein von Magnesium-Ionen voraus und hat ihr pH-Wert-Optimum bei etwa 7,2.[5] Die Hydrolyse des 2,3-DPG zum 3-PG verläuft unter Verbrauch eines Wassermoleküls sowie Freisetzung eines anorganischen Phosphats, und läuft verstärkt bei einem sauren pH-Wert ab. Die Aminosäuresequenz der humanen BPGM, die eine molare Masse von 30.005 Dalton hat und eine homodimere Struktur aufweist, hat eine Länge von 259 Aminosäuren.[6] Das im Rapoport-Luebering-Zyklus gebildete 2,3-DPG ist ein wichtiger biochemischer Effektor für die Regulation der Bindungfähigkeit (Affinität) des Blutfarbstoffs Hämoglobin für das Atemgas Sauerstoff. Die Bisphosphoglyceratmutase kommt dementsprechend vor allem in den Erythrozyten (roten Blutkörperchen) und in erythropoetischem Gewebe von Säugetieren vor. Weitere Aktivitäten wurden darüber hinaus unter anderem in Plazentagewebe[7] und, in deutlich geringerem Ausmaß, in der Leber gefunden.[8]
Entdeckungsgeschichte
Die Reaktionen zur Bildung und Spaltung von 2,3-Diphosphoglycerat wurden vom österreichisch-amerikanisch-deutschen Biochemiker Samuel Mitja Rapoport und seiner technischen Assistentin Janet Luebering in den 1940er Jahren in den Vereinigten Staaten entdeckt und Anfang der 1950er Jahre in mehreren Publikationen beschrieben.[9][10] In den 1960er und 1970er Jahren wurden die Eigenschaften[11] des Enzyms Bisphosphoglyceratmutase und ihre trifunktionale Aktivität[4] näher charakterisiert. Die Aminosäuresequenz der humanen BPGM wurde 1983 aufgeklärt,[12], die Nukleotidsequenz des entsprechenden Gens fünf Jahre später.[8] Im Jahr 2004 wurde die Kristallstruktur des Enzymmoleküls veröffentlicht.[2]
Einzelnachweise
- ↑ T. Fujita et al.: Human Erythrocyte Bisphosphoglycerate Mutase: Inactivation by Glycation In Vivo and In Vitro. In: Journal of Biochemistry. 124(6)/1998. Japanese Biochemical Society, S. 1237–1244, ISSN 0021-924X
- ↑ a b Y. Wang et al.: Crystal Structure of Human Bisphosphoglycerate Mutase. In: Journal of Biological Chemistry. 279/2004. The American Society for Biochemistry and Molecular Biology, S. 39132–39138, ISSN 0021-9258
- ↑ P. Ravel, C.T. Craescu, N. Arous, J. Rosa, M.C. Gare: Critical Role of Human Bisphosphoglycerate Mutase Cys22 in the Phosphatase Activator-binding Site. In: Journal of Biological Chemistry. 272/1997. The American Society for Biochemistry and Molecular Biology, S. 14045–14050, ISSN 0021-9258
- ↑ a b R. Sasaki, K. Ikura, E. Sugimoto, H. Chiba: Purification of bisphosphoglycerate mutase, bisphosphoglycerate phosphatase and phosphoglycerate mutase from human erythrocytes: three enzyme activities in one protein. In: European Journal of Biochemistry. 50(3)/1975. Federation of European Biochemical Societies, S. 581–593, ISSN 1742-464X
- ↑ Gerhard Michal: Biochemical Pathways: Biochemie-Atlas. Spektrum Akademischer Verlag, Heidelberg 1999, ISBN 3-86-025239-9, S. 27/28
- ↑ UniProt: Bisphosphoglycerate mutase – Homo sapiens (Human) (abgerufen am 26. November 2008)
- ↑ D.C. Pritlove, M. Gu, C.A. Boyd, H.S. Randeva, M. Vatish: Novel placental expression of 2,3-bisphosphoglycerate mutase. In: Placenta. 27(6)/2006. W.B. Saunders, S. 924–927, ISSN 0143-4004
- ↑ a b V. Joulin et al.: Isolation and characterization of the human 2,3-bisphosphoglycerate mutase gene. In: Journal of Biological Chemistry. 263/1988. The American Society for Biochemistry and Molecular Biology, S. 15785–15790, ISSN 0021-9258
- ↑ S. Rapoport, J. Luebering: The formation of 2,3-diphosphoglycerate in rabbit erythrocytes: The existence of a diphosphoglycerate mutase. In: Journal of Biological Chemistry. 183/1950. S. 507–516
- ↑ S. Rapoport, J. Luebering: Glycerate-2,3-diphosphatase. In: Journal of Biological Chemistry. 189/1951. S. 683–694
- ↑ Z.B. Rose: The Purification and Properties of Diphosphoglycerate Mutase from Human Erythrocytes. In: Journal of Biological Chemistry. 243(18)/1968. The American Society for Biochemistry and Molecular Biology, S. 4810–4820, ISSN 0021-9258
- ↑ N.W. Haggarty, B. Dunbar, L.A. Fothergill: The complete amino acid sequence of human erythrocyte diphosphoglycerate mutase. In: EMBO Journal. 2(7)/1983. Oxford University Press, S. 1213–1220, ISSN 0261-4189
Weblinks
- UniProt: Bisphosphoglycerate mutase – Homo sapiens (Human) UniProt-Informationen zur Bisphosphoglyceratmutase (englisch)
Wikimedia Foundation.