- 2,3-Xylenol
-
Die Xylenole oder Dimethylphenole bilden eine Gruppe von aromatischen Verbindungen mit zwei Methylgruppen und einer Hydroxygruppe. Man kann sie als Hydroxyderivate der Xylole oder Dimethylderivate des Phenols auffassen. Es existieren somit sechs verschiedene Isomere. Der Name Xylenol leitet sich aus der Kombination der Namen der Aromaten Xylen und Phenol ab.
Inhaltsverzeichnis
Struktur und Eigenschaften
Die physikalischen Eigenschaften der sechs Xylenol-Isomere ähneln einander. Die Xylenole sind in Wasser zumeist nur sehr wenig löslich. Sie bilden farblose bis gelbliche Nadeln oder Platten mit stechendem Geruch. Chemisch verhalten sie sich wie typische Phenole, so bilden sie zum Beispiel in alkalischer Lösung Phenolate, die eine bedeutend höhere Wasserlöslichkeit besitzen.
Die Methylgruppen üben einen (schwachen) +I-Effekt auf den Aromaten aus, wodurch die Elektronendichte im Ring erhöht wird. Dadurch wird u. a. die Acidität des phenolischen OH abgeschwächt. Die pKs-Werte sind daher etwas höher als die des Phenols (9,99[1]) und auch der Kresole.
Xylenole Name 2,3-Xylenol 2,4-Xylenol 2,5-Xylenol 2,6-Xylenol 3,4-Xylenol 3,5-Xylenol Andere Namen 2,3-Dimethyl-
phenol,
vic.-o-Xylenol2,4-Dimethyl-
phenol,
asym.-m-Xylenol2,5-Dimethyl-
phenol,
p-Xylenol2,6-Dimethyl-
phenol,
vic.-m-Xylenol3,4-Dimethyl-
phenol,
asym.-o-Xylenol3,5-Dimethyl-
phenol,
sym.-m-XylenolStrukturformel 
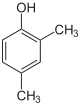
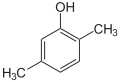
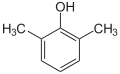

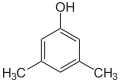
CAS-Nummer 526-75-0 105-67-9 95-87-4 576-26-1 95-65-8 108-68-9 1300-71-6 (Isomerengemisch)[2] PubChem 10687 7771 7267 11335 7249 7948 Summenformel C8H10O Molare Masse 122,17 g·mol−1 Aggregatzustand fest, Isomerengemisch meist flüssig Kurzbeschreibung farblose bis gelbliche Nadeln oder Platten mit stechendem Geruch Schmelzpunkt 73–75,5 °C[3] 24 °C[4] 75–77 °C[5] 46–48 °C[6] 65–68 °C[7] 61 °C[8] Siedepunkt 216 °C[3] 210 °C[4] 212 °C[5] 203 °C[6] 226 °C[7] 219 °C[8] pKs-Wert[1] 10,50 10,45 10,22 10,59 10,32 10,15 Löslichkeit wenig löslich in Wasser (2,6-Xylenol: gut bis sehr gut wasserlöslich[6], 3,4-Xylenol: mischbar[7]),
gut löslich in Ethanol und EtherGefahrstoff-
kennzeichnung
nach RL 67/548/EWG, Anh. I

Giftig Umwelt-
gefährlich(T) (N) 
Giftig (T) R-Sätze 24/25-34-51/53[9] 24/25-34[8][10] S-Sätze (1/2)-26-36/37/39-45-61 (1/2)-26-28-36/37/39-45 Vorkommen
Alle Xylenole finden sich im Steinkohlenteer und Buchenholzteer und sind ein Bestandteil des Stoffgemisches Kreosot.[11]
Darstellung
Xylenole können in der Regel aus den Xylidinen durch Diazotierung und anschließende Verkochung des Diazoniumsalzes dargestellt werden.
Verwendung
Zusammen mit den Kresolen und Kresolsäuren sind Xylenole eine wichtige Klasse von Phenolen mit großer industrieller Bedeutung. Xylenole werden als Ausgangsstoffe zur Synthese von Pestiziden, Antioxidantien und Pharmazeutika (z. B. Mexiletin) verwendet. Das 2,5-Xylenol (p-Xylenol) dient als Grundlage zur Darstellung der pH-Indikatoren Xylenolphthalein, Xylenolblau und Bromxylenolblau. Aus dem 2,6-Xylenol leiten sich Metallphthalein und Xylenolorange ab, sie werden als Indikatoren in der Komplexometrie eingesetzt. 2,6-Xylenol dient als Ausgangsstoff für die Synthese von Polyphenylenether.
Einzelnachweise
- ↑ a b CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ Eintrag zu CAS-Nr. 1300-71-6 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 21. März 2008 (JavaScript erforderlich).
- ↑ a b Eintrag zu CAS-Nr. 526-75-0 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 21. März 2008 (JavaScript erforderlich).
- ↑ a b Eintrag zu CAS-Nr. 105-67-9 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 21. März 2008 (JavaScript erforderlich).
- ↑ a b Eintrag zu CAS-Nr. 95-87-4 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 21. März 2008 (JavaScript erforderlich).
- ↑ a b c Eintrag zu CAS-Nr. 576-26-1 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 21. März 2008 (JavaScript erforderlich).
- ↑ a b c Eintrag zu CAS-Nr. 95-65-8 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 21. März 2008 (JavaScript erforderlich).
- ↑ a b c Eintrag zu CAS-Nr. 108-68-9 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 21. März 2008 (JavaScript erforderlich).
- ↑ Eintrag zu CAS-Nr. 1300-71-6 im European chemical Substances Information System ESIS.
- ↑ Eintrag zu CAS-Nr. 108-68-9 im European chemical Substances Information System ESIS.
- ↑ H. P. T. Ammon, C. Hunnius: Hunnius pharmazeutisches Wörterbuch, S. 867, Verlag Walter de Gruyter 2004, ISBN 3-11-017475-8.
Wikimedia Foundation.
