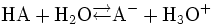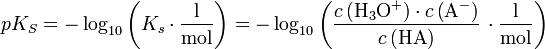- Henderson-hasselbalch
-
Die Henderson-Hasselbalch-Gleichung, auch Puffergleichung genannt, geht auf Lawrence Joseph Henderson und Karl Albert Hasselbalch zurück. Henderson entwickelte seine nach ihm benannte Gleichung 1908. Hasselbalch konnte die Henderson-Gleichung experimentell beim menschlichen Blut bestätigen und schrieb die Gleichung 1916 um, um statt der Wasserstoffionenkonzentration den pH-Wert zu berechnen.
Die Gleichung beschreibt allgemein ein Säure-Base-Gleichgewicht einer teilweise dissoziierten, also schwachen Säure oder Base in wässriger Lösung. Mit Hilfe dieser Gleichung kann man den pH-Wert einer solchen Lösung berechnen.
Diese Gleichung leitet sich aus einer allgemeinen Säure-Base-Reaktion ab:
Hierbei ist HA eine allgemeine Säure und A- eine allgemeine Base.
Die Säurekonstante KS von HA ergibt sich aus dem Massenwirkungsgesetz. Nach Logarithmieren erhält man daraus die Henderson-Hasselbalch-Gleichung:
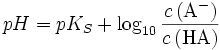 mit
mit 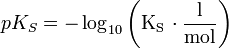 .
.
Dabei wird die Definition des pKS-Wertes benutzt
sowie des pH-Wertes
![pH = - \log_{10} \left[ c \left( \mathrm{{H}_{3}O^{+}} \right) \, \cdot \mathrm{\frac{l}{mol}} \right]](/pictures/dewiki/55/7e6160a5d03e78cad760de0d0f44739f.png) .
.
Im Pufferbereich der Titration entspricht das Verhältnis
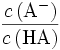 dem Verhältnis
dem Verhältnis 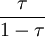 , so dass man schreiben kann:
, so dass man schreiben kann: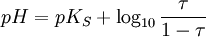 .
.
τ ist dabei das Verhältnis der Stoffmenge (bzw. der Konzentration) der zugefügten Maßlösung zur Stoffmenge (bzw. der Konzentration) des zu bestimmenden Stoffes.[1]
Im Bereich von τ=0 und τ=1 bzw. bei stärkerer Verdünnung (0,01 M) gilt diese Formel nicht mehr, da die geringe Protolyse von HA bzw. A- mit dem Lösungsmittel bzw. die Autoprotolyse von Wasser um den pH von 7 (z.B. Phosphatpuffer) selbst für die Konzentrationsberechnung berücksichtigt werden müssen und es kann durchaus zu Abweichungen von 0,4 vom berechneten pH kommen. Für eine genaue Berechnung des pH-Wertes leite man sich die Gleichung nach dem Massenwirkungsgesetz her.
Diese Gleichung wird insbesondere bei der pH-Wert-Berechnung von Pufferlösungen verwendet, zu bedenken ist aber, dass zur Vereinfachung angenommen wird, die Basen- und Säurenkonzentration sei im Gleichgewicht gleich den Anfangskonzentrationen.
Siehe auch
Einzelnachweise
Wikimedia Foundation.