- Alpha-Naphthol
-
Naphthole Name 1-Naphthol 2-Naphthol Andere Namen α-Naphthol,
1-Hydroxynaphthalinβ-Naphthol,
2-HydroxynaphthalinStrukturformel 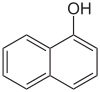
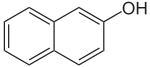
CAS-Nummer 90-15-3 205-182-7 PubChem 7005 8663 Summenformel C10H8O Molare Masse 144,17 g·mol−1 Aggregatzustand fest Kurzbeschreibung farblose Kristalle
mit schwach
phenolartigem Geruchweiß bis gelbliches
kristallines Pulver
mit phenolartigem GeruchSchmelzpunkt 95–97 °C[1] 123 °C[2] Siedepunkt 288 °C[1] 285 °C[2] pKs-Wert[3] 9,30 9,57 Löslichkeit praktisch unlöslich in Wasser (0,1 g/l) Gefahrstoff-
kennzeichnung
[1][2]
Gesundheits-
schädlich(Xn) 

Gesundheits-
schädlichUmwelt-
gefährlich(Xn) (N) R-Sätze 21/22-37/38-41 20/22-50 S-Sätze (2)-22-26-37/39 (2)-24/25-61 Naphthole können auch als Hydroxynaphthaline bezeichnet werden, da sie Derivate des Naphthalins sind, in denen ein oder mehrere Wasserstoffatome durch Hydroxylgruppen ersetzt sind. Die einfachsten Naphthole sind das 1-Naphthol (α-Naphthol, 1-Hydroxynaphthalin) und das 2-Naphthol (β-Naphthol, 2-Hydroxynaphthalin).
Eigenschaften
Naphthole reagieren chemisch ähnlich wie Phenole, sind aber meist reaktionsfähiger. Naphthole sind in kaltem Wasser schwer, in heißem Wasser besser löslich. Da Naphthole wie die Phenole schwache Säuren sind, sind sie in verdünnter Natronlauge besser löslich als in Wasser. Organische Lösungsmittel wie Ethanol, Ether und Benzol lösen Naphthole gut.
Verwendung
- Unter Einwirkung einer starken Säure, wie z. B. konzentrierter Schwefelsäure, bilden sich aus Pentosen und Hexosen durch intramolekulare Dehydratisierung Furfural bzw. 5-Hydroxymethylfurfural. Dieses kondensiert mit 1-Naphthol zu einem violetten Farbstoff (Molisch-Probe).
- Die Naphthole werden oftmals zur Synthese von Azofarbstoffen eingesetzt. So wird z. B. 2-Naphthol mit 4-Nitroanilin zum Pararot gekuppelt:[4]
-
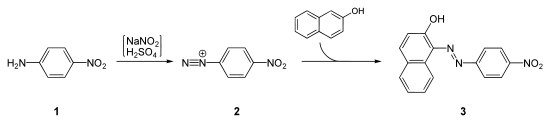 Synthese von Pararot ausgehend von 4-Nitroanilin (1). Dieses reagiert nach Einwirken von Schwefelsäure und Natriumnitrit zu einem Diazoniumsalz (2), welches mit 2-Naphthol zum Pararot (3) gekuppelt wird.
Synthese von Pararot ausgehend von 4-Nitroanilin (1). Dieses reagiert nach Einwirken von Schwefelsäure und Natriumnitrit zu einem Diazoniumsalz (2), welches mit 2-Naphthol zum Pararot (3) gekuppelt wird.
Einzelnachweise
- ↑ a b c Eintrag zu CAS-Nr. 90-15-3 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 23. März 2008 (JavaScript erforderlich).
- ↑ a b c Eintrag zu CAS-Nr. 205-182-7 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 23. März 2008 (JavaScript erforderlich).
- ↑ CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ J. R. Mohrig, T. C. Morrill, C. N. Hammond, D. C. Neckers: Synthesis 5: Synthesis of the Dye Para Red from Aniline, in: Experimental Organic Chemistry Freeman: New York, NY, 1997; S. 456–467.
Wikimedia Foundation.
