- Hittorfsche Methode
-
Als Überführungszahl wird der Bruchteil des gesamten elektrischen Stromes bezeichnet, der von einer bestimmten Ionensorte transportiert wird. Zu Ehren des deutschen Physikochemikers Johann Wilhelm Hittorf wird diese Größe auch Hittorfsche Überführungszahl genannt.
Die Überführungszahl der Ionen i kann mathematisch folgendermaßen definiert werden:
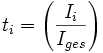
ti Überführungszahl der Ionensorte i
Ii elektrischer Strom, der von diesen Ionen transportiert wird
Iges gesamter elektrischer Strom
Die Überführungszahl hängt von der Ionenkonzentration und der Ionenbeweglichkeit ab. Beide Abhängigkeiten sind einfach zu verstehen: Ist die Konzentration der Ionensorte i hoch, kann von diesen Ionen ein großer Anteil des elektrischen Stroms transportiert werden. Ebenso der Zusammenhang mit der Ionenbeweglichkeit: Schnelle Ionen vermögen einen größeren Teil des Stroms zu transportieren als langsame.
Inhaltsverzeichnis
Bestimmung der Überführungszahl
Die Hittorfsche Methode
Zur Bestimmung der Überführungszahl eignet sich eine in drei Räume aufgeteilte Elektrolyseapparatur. Diese setzt sich aus dem Kathodenraum, dem Mittelraum und dem Anodenraum zusammen. In den Kathoden-, sowie Anodenraum werden Platinelektroden eingetaucht. Die Elektrolyseräume werden mit dem Elektrolyten befüllt und mittels Brücke verbunden. Betrachtet man die beiden Elektrodenräume, so wird man sehen, dass die Konzentrationen der Kationen und der Anionen sich unterschiedlich ändern.
Bei diesem Experiment errechnet man die Überführungszahl folgendermaßen:
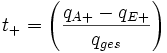 Überführungszahl der Kationen
Überführungszahl der Kationen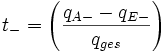 Überführungszahl der Anionen
Überführungszahl der Anionendas Verhältnis zwischen der Differenz der anfangs qA und am Ende qE im entsprechenden Raum vorhandene Ladungsmenge und der durch den Elektrolyten geflossenen Ladungsmenge qges.
Die Endladungsmenge setzt sich folgendermaßen zusammen:
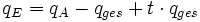
Mit der Definition der Ladungsmenge und anschließendem Auflösen der obigen Gleichung kommt man zum folgenden Ergebnis.
Definition Ladungsmenge:
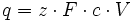
F = Faraday-Konstante ; z = Ladungszahl ; c = Konzentration des betrachteten Ions ; V = Volumen des Elektrolyseraumes
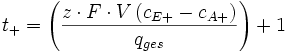
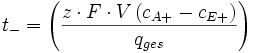
Anhand dieser Gleichung kann über eine Konzentrations-, Strom- und Volumenbestimmung eines Elektrodenraums, die Überführungszahl bestimmt werden.
Aus Kenntnis der molaren Grenzleitfähigkeiten von Ionen lassen sich auch die Wanderungsgeschwindigkeiten und damit die Überführungszahlen von Ionen bei Elektrolysen ermitteln. Bei einer Elektrolyse wandern einige Ionen sehr schnell (z.B. H+, OH-) andere recht langsam (Li+, CH3COO-).
Für die Überführungszahlen von Kationen gilt: t+ = ν + *
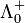 / Λ0.
/ Λ0.Für die Überführungszahlen von Anionen gilt: t- = ν − *
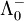 / Λ0.
/ Λ0.Es ist: t- + t+ = 1.
Die Methode der wandernden Grenzfläche
Die Grenzfläche zweier aneinanderstoßender Elektrolyte verschiebt sich unter dem Einfluss eines elektrischen Feldes. Verwendet man ein farbiges Ion und gelingt es, die Grenzfläche während des Versuchs einigermaßen scharf zu halten, so kann man aus der Geschwindigkeit dieser Verschiebung die Überführungszahlen bestimmen.
Im Prinzip genügt es, einmal die Überführungszahl eines beliebigen Ions zu messen. Die Ionenbeweglichkeiten aller anderen Ionen lassen sich dann durch Kombination mit diesem Ion aus Leitfähigkeitsmessungen bestimmen. Die equivalenten Ionenbeweglichkeiten der meisten Ionen in wässriger Lösung liegen bei 3–10·10 − 3m2/(valΩ). Lediglich das Proton und das Hydroxylion sind wesentlich beweglicher. Dies beruht auf dem besonderen Bewegungsmechanismus dieser Ionen: zu der normalen Ionenwanderung tritt hier noch eine synchrone, sprunghafte Ortsveränderung vieler Protonen über zwischenmolekulare Wasserstoffbrücken.Anwendungsbezug
Bei Salzbrücken wird darauf geachtet, dass die Überführungszahlen von Anionen und Kationen annähernd gleich sind.
Wikimedia Foundation.
