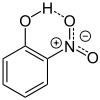
- 2-Nitrophenol
-
Die Nitrophenole bilden eine größere Gruppe aromatischer Nitro-Verbindungen, die sich vom Phenol ableiten. Sie sind zumeist durch Nitrierung von Phenol mit (konzentrierter) Salpetersäure zugänglich. Einige Nitrophenole fallen durch ihre intensive gelbe Farbe auf. Je nach Zahl der Nitrogruppen unterscheidet man zwischen den (Mono-)Nitrophenolen, von denen drei Konstitutionsisomere existieren, Dinitrophenolen mit sechs isomeren Verbindungen, von denen hauptsächlich 2,4-Dinitrophenol praktische Bedeutung hat. Unter den Trinitrophenolen ist der wichtigste Vertreter das 2,4,6-Trinitrophenol mit dem Trivialnamen Pikrinsäure.
Inhaltsverzeichnis
Acidität
verschiedene Nitrophenole und ihre pKs-Werte Name Phenol 4-Nitrophenol 2,4-Dinitrophenol Pikrinsäure Strukturformel 

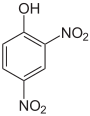
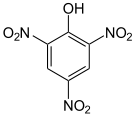
pKs-Wert[1] 9,99 7,16 4,09 0,29 Der schwach saure Charakter des Phenols ist durch die Mesomeriestabilisierung des Phenolat-Ions zu begründen. Die Nitrogruppen wirken elektronenziehend; die phenolische OH-Bindung wird zunehmend polarisiert. Mit zunehmendem Grad der Nitrierung nimmt die Säurestärke daher deutlich zu. An der Spitze steht das 2,4,6-Trinitrophenol, es trägt den Trivialnamen Pikrinsäure und besitzt eine Säurestärke in der Größenordnung von Mineralsäuren.
Verwendung
Nitrophenole fallen in der chemischen, pharmazeutischen und Rüstungsindustrie als Zwischenprodukte bei der Produktion von Farben, Leder, Gummi, Pestiziden, Fungiziden, Schädlingsbekämpfungsmitteln und Munition an.
Sicherheitshinweise
Nitrophenole sind giftig beim Einatmen, Verschlucken und Kontakt mit der Haut. Es können Reizungen der Augen, der Verdauungswege, Blutvergiftung, Leberschaden, Schwindel, Übelkeit, Kopfschmerz und Atemwegsreizung auftreten. Möglicherweise wirken sie krebserregend und sensibilisierend. In Verbindung mit Alkohol wird die Wirkung verstärkt. Bei Berührung mit der Haut sollte sofort mit viel Wasser abgewaschen werden. Sie haben giftige Wirkung auf das Nervensystem von Lebewesen.
Ein großes Problem stellt die Entfernung von Nitrophenolen und verwandten Verbindungen aus dem Grundwasser dar. Solche Kontaminationen sind mitunter in ehemaligen Sprengstoff- oder Farbenfabriken und militärischen Anlagen zu finden. Eine neue Entwicklung zur vollständigen Entfernung von Nitrophenolen aus Grundwasser ist ein Katalysator, der aus Eisen mit einem Tetra-Amido-Makrozyklischen Liganden (Fe-TAML) besteht und die Oxidation der Gifte durch Wasserstoffperoxid ermöglicht. Dabei fallen keine weiteren giftigen Substanzen an. Der Katalysator wurde an der Carnegie Mellon University entwickelt.[2]
Verbindungen
Je nach Substitutionsgrad mit Nitrogruppen unterscheidet man zwischen:
- (Mono-)Nitrophenole (drei isomere Verbindungen)
- Dinitrophenole (sechs isomere Verbindungen, von denen das 2,4-Dinitrophenol am wichtigsten ist)
- Trinitrophenole (fünf isomere Verbindungen, mit dem Hauptvertreter 2,4,6-Trinitrophenol = Pikrinsäure)
- Tetranitrophenole
- Pentanitrophenol
(Mono-)Nitrophenole
Nitrophenole Name o-Nitrophenol m-Nitrophenol p-Nitrophenol Andere Namen 2-Nitrophenol,
1-Hydroxy-2-nitrobenzol3-Nitrophenol,
1-Hydroxy-3-nitrobenzol4-Nitrophenol,
1-Hydroxy-4-nitrobenzolStrukturformel 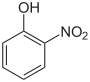
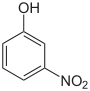

CAS-Nummer 88-75-5 554-84-7 100-02-7 PubChem 6947 11137 980 Summenformel C6H5NO3 Molare Masse 139,11 g•mol−1 Aggregatzustand fest Kurzbeschreibung gelbliche Nadeln
oder Prismen[3][4]farblose Kristalle[5]
farblose Kristalle [6][4] Schmelzpunkt 44 °C[3] 97 °C[5] 113–115 °C[6] Siedepunkt 214 °C[3] 194 °C[5] Zers.[6] pKs-Wert[1] 7,21 8,38 7,16 Löslichkeit 2,1 g/l (20 °C)[3] 13,5 g/l (25 °C)[5] 14,8 g/l (25 °C)[6] schwerlöslich in Wasser, löslich in Ethanol, Ether und Chloroform Gefahrstoff-
kennzeichnung
[3][5][6]
Reizend (Xi) 
Gesundheits-
schädlich(Xn) 
Gesundheits-
schädlich(Xn) R-Sätze 38 21/22-36-52/53 20/21/22-33 S-Sätze keine S-Sätze 26-28-36-61 (2)-28 Darstellung
o- und p-Nitrophenol entstehen im Gemisch bei der Nitrierung von Phenol mit verdünnter Salpetersäure. Der −I-Effekt und der +M-Effekt der Hydroxygruppe des Phenols wirken bei der Zweitsubstitution ortho-para-dirigierend. Die Trennung gelingt mittels Wasserdampfdestillation, wobei nur das o-Nitrophenol übergeht. Beide Isomere können zu 2,4-Dinitrophenol und zu Pikrinsäure weiternitriert werden.
Die Darstellung von m-Nitrophenol gelingt in zwei Stufen, zunächst durch Halogenierung (z. B. Cl2/AlCl3) von Nitrobenzol (meta-dirigierend); anschließend erfolgt in einer nukleophilen aromatischen Substitution der Tausch des Halogenatoms durch OH. Ein weiterer Weg läuft über die Diazotierung von m-Nitroanilin und anschließendes Verkochen des Diazoniumsalzes.
Eigenschaften
Nitrophenole sind kristalline Feststoffe; sie sind schwerlöslich in Wasser, löslich in Ethanol, Ether und Chloroform. p-Nitrophenol hat einen schwach phenolartigen Geruch.
pKs-Werte
o- und p-Nitrophenol besitzen gegenüber dem m-Nitrophenol einen niedrigeren pKs-Wert; damit sind deren Aciditäten größer. Bei der ortho- und para-Form kann das Phenolat-Ion eine Doppelbindung auf die elektronenziehende Nitrogruppe (−M-Effekt) verschieben. Das zweite O kann dort einen negativen Ladungsschwerpunkt ausbilden. Bei der meta-Form ist das nicht möglich.
Schmelzpunkte
Die Schmelzpunkte zeigen deutliche Unterschiede. Das o-Nitrophenol besitzt den niedrigsten Schmelzpunkt, da es eine intramolekulare Wasserstoffbrücke ausbilden kann. Die beiden anderen Isomere bilden im Gegensatz dazu intermolekulare Wasserstoffbrücken aus. Beim o-Nitrophenol ist Energie zum Aufbrechen dieser Brücken nicht erforderlich. Das p-Nitrophenol besitzt aufgrund seiner Symmetrie den höchsten Schmelzpunkt.
Löslichkeit in Wasser
Die Nitrophenole sind in Wasser schwerlöslich, die Werte unterscheiden sich aber innerhalb dieser Gruppe. Die deutlich schlechtere Löslichkeit des o-Nitrophenols in Wasser lässt sich ebenfalls mit der intramolekularen Wasserstoffbrücke gut erklären. Das Molekül ist dadurch nach außen hin deutlich unpolarer. Dagegen sind die Löslichkeiten des m- und p-Nitrophenols etwa gleich und im Vergleich deutlich besser. Hier bilden sich nun zwischen der phenolischen Hydroxygruppe und Wasser eher intermolekulare Wasserstoffbrücken.
Dinitrophenole
- Hauptartikel: Dinitrophenole
Die Dinitrophenole bilden eine Gruppe von Verbindungen mit einer Hydroxygruppe und zwei Nitrogruppen. Es existieren sechs verschiedene Isomere, von denen das 2,4-Dinitrophenol das wichtigste ist. Letzteres entsteht aus o- und p-Nitrophenol durch erneute Nitrierung.
Dinitrophenole Name 2,3-Dinitrophenol 2,4-Dinitrophenol 2,5-Dinitrophenol 2,6-Dinitrophenol 3,4-Dinitrophenol 3,5-Dinitrophenol Strukturformel 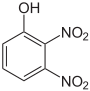

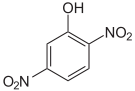
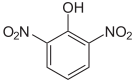
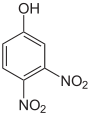
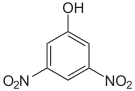
Summenformel: C6H4N2O5; Molare Masse = 184,11 g•mol−1; gelbe, kristalline Feststoffe[7] Trinitrophenole
- Hauptartikel: Pikrinsäure
Die Trinitrophenole bilden eine Gruppe von Verbindungen mit einer Hydroxygruppe und drei Nitrogruppen. Es existieren sechs verschiedene Isomere, von denen das 2,4,6-Trinitrophenol (Pikrinsäure) mit Abstand das wichtigste ist.
Pikrinsäure bildet gelbe, stark bitter schmeckende Kristalle. Bedingt durch die Häufung elektronenziehender Nitrogruppen (–NO2) ist die Pikrinsäure durch ihre phenolische Hydroxylgruppe eine starke Säure (pKs = 0,29[1]). Die Pikrinsäure wird über die Sulfonierung von Phenol und nachfolgende Behandlung mit Salpetersäure hergestellt. Die Verwendung von Pikrinsäure als Füllmaterial für Granaten (wie im Ersten Weltkrieg) oder allgemein als Explosivstoff wurde wegen der unkontrollierten Bildung von hochexplosiven Schwermetallpikraten eingestellt. Die Pikrinsäure wurde hier durch TNT ersetzt.
Trinitrophenole Name 2,3,4-Trinitrophenol
2,3,5-Trinitrophenol
2,3,6-Trinitrophenol
2,4,5-Trinitrophenol
2,4,6-Trinitrophenol
(Pikrinsäure)3,4,5-Trinitrophenol
Strukturformel 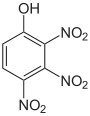
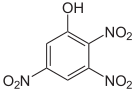
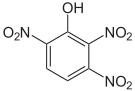
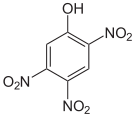

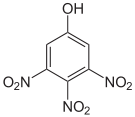
Summenformel: C6H3N3O7; Molare Masse = 229,11 g•mol-1 CAS-Nummer 603-10-3 88-89-1 PubChem 13878536 18329135 3013916 6954 Schmelzpunkt 119–120 °C [8] 122 °C [1] Gefahrstoff-
kennzeichnung
[8][9]

Leicht-
entzündlichGiftig (F) (T) 

Explosions-
gefährlichGiftig (E) (T) R-Sätze 1-4-11-24/25 [8] 2-4-23/24/25 [9] S-Sätze 7-16-35-45 [8] (1/2)-28-35-37-45 [9] Tetra- und Pentanitrophenole
Das 2,3,4,6-Tetranitrophenol (C6H2N4O9) ist derart brisant und explosibel, dass es nicht transportiert werden darf. Das Pentanitrophenol (C6HN5O11) ist ein Hydrolyseprodukt des Hexanitrobenzols.
Tetra- und Pentanitrophenole Name 2,3,4,5-Tetranitrophenol 2,3,4,6-Tetranitrophenol 2,3,5,6-Tetranitrophenol Pentanitrophenol Strukturformel 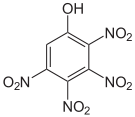
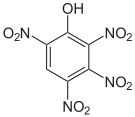
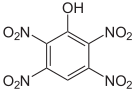
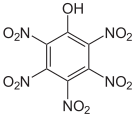
Summenformel C6H2N4O9 C6HN5O11 Molare Masse 274,10 g•mol-1 CAS-Nummer 641-16-7 PubChem 21523193 61190 Einzelnachweise
- ↑ a b c d CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ WELT online: Katalysator baut Nitrophenol ab (30. August 2005), abgerufen am 25. Februar 2008.
- ↑ a b c d e Eintrag zu o-Nitrophenol in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 20. Februar 2008 (JavaScript erforderlich).
- ↑ a b www.seilnacht.com (Phenol).
- ↑ a b c d e Eintrag zu m-Nitrophenol in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 20. Februar 2008 (JavaScript erforderlich).
- ↑ a b c d e Eintrag zu p-Nitrophenol in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 20. Februar 2008 (JavaScript erforderlich).
- ↑ Eintrag zu CAS-Nr. 25550-58-7 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 18. März 2008 (JavaScript erforderlich).
- ↑ a b c d Datenblatt der Firma Sigma-Aldrich.
- ↑ a b c Eintrag zu CAS-Nr. 88-89-1 im European chemical Substances Information System ESIS.
Literatur
- Allinger, Cava, de Jongh, Johnson, Lebel, Stevens: Organische Chemie, 1. Auflage, Walter de Gruyter, Berlin 1980, ISBN 3-11-004594-X, S. 375–376, 916.
- Streitwieser/Heathcock: Organische Chemie, 1. Auflage, VCH, Weinheim 1980, ISBN 3-527-25810-8, S. 1056, 1179, 1189–1191.
- Beyer/Walter: Lehrbuch der Organischen Chemie, 19. Auflage, S. Hirzel Verlag, Stuttgart 1981, ISBN 3-7776-0356-2, S. 467–468.
- Morrison/Boyd: Lehrbuch der Organischen Chemie, 3. Auflage, VCH, Weinheim 1986, ISBN 3-527-26067-6, S. 1074–1076, 1121–1122.
Weblinks
Wikimedia Foundation.