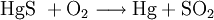- Hydrargyrum
-
Eigenschaften Allgemein Name, Symbol, Ordnungszahl Quecksilber, Hg, 80 Serie Übergangsmetalle Gruppe, Periode, Block 12, 6, d Aussehen silbrig weiß CAS-Nummer 7439-97-6 ATC-Code D08AK05
Massenanteil an der Erdhülle 4 · 10−5 % Atomar Atommasse 200,59 u Atomradius (berechnet) 150 (171) pm Kovalenter Radius 149 pm Van-der-Waals-Radius 155 pm Elektronenkonfiguration [Xe] 4f145d106s2 Elektronen pro Energieniveau 2, 8, 18, 32, 18, 2 Austrittsarbeit 4,5 eV 1. Ionisierungsenergie 1007,1 kJ/mol 2. Ionisierungsenergie 1810 kJ/mol Physikalisch Aggregatzustand flüssig Kristallstruktur entfällt Dichte 13,546 g/cm3 bei 293,15 K Mohshärte entfällt Schmelzpunkt 234,32 K (−38,83 °C) Siedepunkt 629,88 K (356,73 °C) Molares Volumen 14,09 · 10−6 m3/mol Verdampfungswärme 59,229 kJ/mol Schmelzwärme 2,295 kJ/mol Dampfdruck 0,0002 Pa bei 234 K Schallgeschwindigkeit 1407 m/s bei 293,15 K Spezifische Wärmekapazität 140 J/(kg · K) Elektrische Leitfähigkeit 1,04 · 106 A/(V · m) Wärmeleitfähigkeit 8,34 W/(m · K) Chemisch Oxidationszustände 1, 2, 4[1] [2] Oxide (Basizität) Hg2O, HgO (leicht basisch) Normalpotential 0,851 V (Hg2+ + 2e− → Hg) Elektronegativität 2,00 (Pauling-Skala) Isotope Isotop NH t1/2 ZM ZE MeV ZP 192Hg 4,85 h ε 0,700 192Au 193Hg 3,80 h ε 2,340 193Au 194Hg 444 a ε 0,040 194Au 195Hg 9,9 h ε 1,510 195Au 196Hg 0,15 %
Stabil 197Hg 64,14 h ε 0,600 197Au 198Hg 9,97 %
Stabil 199Hg 16,87 %
Stabil 200Hg 23,1 %
Stabil 201Hg 13,18 %
Stabil 202Hg 29,86 %
Stabil 203Hg 46,612 d β− 0,462 203Tl 204Hg 6,87 %
Stabil 205Hg 5,2 min β− 1,531 205Tl 206Hg 8,15 min β− 1,308 206Tl NMR-Eigenschaften Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 

Sehr giftig Umwelt-
gefährlich(T+) (N) R- und S-Sätze R: 61-26-48/23-50/53 S: 53-45-60-61 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet.
Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen.Quecksilber (gr., lat. hydrargyrum, Name gegeben von Dioskurides; engl. Mercury) ist ein chemisches Element im Periodensystem der Elemente mit dem Symbol Hg und der Ordnungszahl 80. Es ist das einzige Metall und neben Brom das einzige Element, das bei Normalbedingungen flüssig ist. Aufgrund seiner hohen Oberflächenspannung benetzt Quecksilber seine Unterlage nicht, sondern bildet wegen seiner starken Kohäsion linsenförmige Tropfen. Es ist wie jedes andere Metall elektrisch leitfähig.
Inhaltsverzeichnis
Etymologie
Quecksilber bedeutet ursprünglich lebendiges Silber (althochdeutsch quëcsilabar, quëchsilper, mittelhochdeutsch quëcsilber, këcsilber zu germanisch kwikw „(quick)lebendig“)[4]. Das Wort Hydrargyrum ist zusammengesetzt aus den griechischen Wörtern hydor „Wasser“ und argyros „Silber“ sowie dem lateinischen Suffix -um. Der Ausdruck ist somit latinisiertes Griechisch und kann mit „flüssiges Silber“ übersetzt werden; ähnlich das lateinische argentum vivum[4] (dt. lebendiges Silber).
Geschichte
Quecksilber ist seit prähistorischer Zeit bekannt. So wird es schon in den Werken von Aristoteles, Plinius des Älteren und anderen Schriftstellern der Antike erwähnt. Im Altertum wurde es als Heilmittel verwendet (aufgrund seiner Toxizität jedoch mit entsprechend negativen Folgen).
Am Quecksilber wurde vom niederländischen Physiker Heike Kamerlingh Onnes im Jahre 1911 das erste Mal das Phänomen der Supraleitung entdeckt.[5] Ab einer Temperatur von 4,2 Kelvin (−268,9 Grad Celsius) verschwindet dabei der elektrische Widerstand vollständig.
Alchemie
In der griechischen Antike symbolisierte das Quecksilber den Gott und den Planeten Merkur. Dies wurde von den Römern und den Alchemisten übernommen. Daher ist im Englischen mercury sowohl die Bezeichnung für das Quecksilber, als auch für den Planeten und den Gott.
Für die mittelalterlichen Alchemisten waren Quecksilber, Schwefel und Salz die drei grundlegenden Elemente. Das Einhorn symbolisierte das Quecksilber.
Vorkommen
Quecksilbervorkommen gibt es unter anderem in Serbien, Italien, China, Algerien, Russland und Spanien. Meist findet man es als Mineral in Form von Zinnober (HgS) in Gebieten mit ehemaliger vulkanischer Aktivität. Seltener kommt Quecksilber auch gediegen vor. Im spanischen Ort Almadén befinden sich die größten Zinnober-Vorkommen der Erde. Die Förderung wurde im Jahr 2000 beendet und die Minen zu touristischen Attraktionen umgearbeitet.
Gewinnung und Darstellung
Reines Quecksilber wird gewonnen, indem man das Quecksilbererz Zinnober (HgS) mit Sauerstoff reagieren lässt (Röstverfahren).
Eigenschaften
Quecksilber ist ein silberweißes, flüssiges Schwermetall. Es wird manchmal noch zu den Edelmetallen gezählt, ist jedoch viel reaktiver als die klassischen Edelmetalle (zum Beispiel Platin, Gold), die in derselben Periode stehen. Es bildet mit sehr vielen Metallen Legierungen, die sogenannten Amalgame. Quecksilber leitet Strom im Vergleich zu anderen Metallen schlecht und verdunstet schon bei Raumtemperatur.
Quecksilber ist etwa 13,5-mal so dicht wie Wasser, sodass nach dem Archimedischen Prinzip seine Tragfähigkeit auch 13,5-mal so hoch ist; somit schwimmt auch ein Eisenwürfel (Dichte etwa 7,87-mal so hoch wie die von Wasser) in Quecksilber.
Aggregatzustand
Die Antwort auf die Frage, warum Quecksilber flüssig ist, findet sich in der Betrachtung der Bindung zwischen den Quecksilberatomen. Quecksilber hat eine einmalige Elektronenkonfiguration, die keine stabile Bindung zwischen den einzelnen Atomen zulässt. Die Atome aller anderen bei Raumtemperatur festen Metalle werden durch das sogenannte Elektronengas elektrostatisch zusammengehalten, welches aus delokalisierten Elektronen der äußeren Schale der Atome besteht.
Die Metallbindung elementarer Metalle kommt durch so genannte Bänder zustande, welche sämtliche Elektronen eines Energieniveaus enthalten. Solche Bänder werden benötigt, um das Pauli-Prinzip zu erfüllen. Bei der Metallbindung springen Elektronen vom Valenzband, dem energetisch am höchsten liegenden mit Elektronen vollbesetzte Band, ins Leitungsband, dem nicht komplett aufgefüllten Band, und zurück. Dadurch werden die Metallatome eine Art schwacher Kationen, die durch die negative Ladung der ferneren Elektronen - auch „Elektronengas“ - zusammengehalten werden. Zugleich sind die Elektronen beweglich genug um als Ladungsträger für elektrischen Strom zu dienen, was die elektrische Leitfähigkeit von Metallen erklärt.
Als Element der 12. Gruppe des PSE besitzen Quecksilberatome komplett gefüllte s- und d-Orbitale, was eine sehr stabile und energetisch günstige Konstellation bedeutet. Das Leitungsband ist dadurch leer. Bei Zink und Cadmium, die in derselben Gruppe des PSE wie Quecksilber stehen, jedoch bei Raumtemperatur fest sind, ist der energetische Unterschied zwischen dem Valenzband zum Leitungsband so gering, dass Elektronen problemlos vom Valenz- ins Leitungsband springen können, wodurch eine Metallbindung zustande kommt.
Die Besonderheit bei Quecksilber liegt in dem zusätzlichen f-Orbital, welches Zink und Cadmium nicht besitzen. Während Zink und Cadmium jeweils 12 Elektronen in der äußersten Schale haben, hat Quecksilber 26 darin. Aufgrund der Lanthanoidenkontraktion und des relativistischen Effekts kommt es zu einem Massezuwachs und einer weniger effizienten Abschirmung der Kernladung.
Besetzte Orbitale werden so näher an den Kern herangezogen, sowie auch das Valenzband des Quecksilbers. Unbesetzte Orbitale, das Leitungsband, werden nicht näher an den Kern gezogen, was zu einer besonders großen Energiedifferenz zwischen Valenz- und Leitungsband führt, die bei Zink und Cadmium deutlich geringer ist. So können kaum Elektronen das Valenzband verlassen, wodurch die Metallbindung außergewöhnlich schwach ausfällt. Dies erklärt zugleich auch die Flüchtigkeit und die für Metalle untypische schlechte Leitfähigkeit des Quecksilbers.
Dampfdruck
Temperatur
(°C)Dampfdruck
(Pa)Dampfdruck
(Torr)Einzelnachweis -39 0,0002 0 0,0467 0,000350 [7] 10 0,103 0,000775 [7] 20 0,242 0,00182 [7] 30 0,543 0,00407 [7] 50 2 [8] 75 9 [8] 100 37 [8] 125 129 [8] 126,2 130 1 [9] 150 383 [8] 164,8 670 5 [9] 204,6 2660 20 [9] 242,0 8000 60 [9] 290,7 26700 200 [9] 323,0 53300 400 [9] Isotope
Von Quecksilber sind insgesamt 34 Isotope und 9 Kernisomere mit Massenzahlen von 175 bis 208 bekannt. 7 dieser Isotope sind stabil (mit den Massen 196, 198, 199, 200, 201, 202 und 204). Von den radioaktiven Isotopen weist nur 194Hg mit 444 Jahren eine relativ lange Halbwertszeit auf. Die anderen Isotope und Kernisomere haben nur Halbwertszeiten zwischen 1,1 Millisekunden und 46,612 Tagen.
Siehe auch: Liste der Quecksilber-Isotope
Verwendung
Thermometer
Die thermische Ausdehnung des Quecksilbers ist recht hoch und zwischen 0 °C und 100 °C direkt proportional zur Temperatur. Außerdem benetzt Quecksilber Glas nicht. Daher eignet es sich zum Einsatz in Flüssigkeitsthermometern und Kontaktthermometern.
Bedingt durch seine starke Toxizität ist der Einsatz heutzutage auf den wissenschaftlichen Bereich beschränkt, es kann teilweise durch gefärbten Alkohol oder Galinstan oder elektronische Thermometer ersetzt werden.
Das erste brauchbare Quecksilberthermometer wurde um 1720 von Daniel Gabriel Fahrenheit entwickelt. In einem Thermometer befinden sich im Schnitt 150 mg Quecksilber. In einem Fieberthermometer kann die Menge bis zu 1 g betragen. Dies entspricht in etwa einem Kügelchen von 5,2 mm Durchmesser.
Ab dem 3. April 2009 ist das Inverkehrbringen von quecksilberhaltigen Fieberthermometern, Barometern und Blutdruckmessgeräten innerhalb der EU verboten, ausgenommen hiervon sind Messgeräte für den wissenschaftlichen oder medizinischen Gebrauch[10].
Manometer/Barometer
Die klassische Bauform eines Manometers („Druckdifferenzmessers“) ist ein U-Rohr, dessen Enden mit den beiden Druckatmosphären über Leitungen verbunden sind. Bis in die heutige Zeit ist Quecksilber als Manometerflüssigkeit weit verbreitet.
Die alte Bauform des Barometers ist ein U-förmiges, aufrecht stehendes Rohr, welches auf einer Seite oben geschlossen ist; damit ist es eine Sonderbauform des Manometers.
Die Quecksilbersäule in der geschlossenen Hälfte sinkt nur soweit ab, bis der Luftdruck und die Gewichtskraft des Quecksilbers sich im Kräftegleichgewicht befinden. Bei Normaldruck (1 Atmosphäre) sind dies 760 mm. Die alte Angabe in der Maßeinheit Torr für den Luftdruck entspricht der Höhe der Quecksilbersäule in Millimetern, 1 mm Quecksilbersäule entsprechen 133,21 Pascal.
Schalter
Durch seine elektrische Leitfähigkeit und die relativ hohe Oberflächenspannung ist Quecksilber ideal für die Anwendung als Kontaktwerkstoff in den früher verwendeten Quecksilberschaltern. Wegen der Problematik bei der Entsorgung von Elektronikschrott ist seit dem Jahr 2005 in der EU („RoHS“-Richtlinie) der Einsatz von Quecksilber in Schaltern untersagt.
Quecksilber-Neigungsschalter funktionieren im Prinzip wie eine Wasserwaage; ein Quecksilbertropfen in einem gebogenen Glasrohr öffnet und schließt neigungsabhängig einen elektrischen Kontakt.
In alten Wechselrichtern (Turbowechselrichter) wurde ein Quecksilberstrahl als "Schalter" benutzt.
Quecksilberdampflampen
Quecksilber wird in Entladungsgefäßen (Quecksilberdampflampen) von Gasentladungslampen (Leuchtstofflampen, „Energiesparlampen“, Kaltkathodenröhren, Quecksilberdampf-Hochdruck- und -höchstdrucklampen, Höhensonne, Quarzlampe, sog. „Schwarzlichtlampe“) eingesetzt.
Amalgam
Quecksilber bildet mit anderen Metallen spontan Amalgame. Amalgame werden z. B. als Zahnfüllmittel eingesetzt. Da Quecksilber durch Amalgambildung die schützende Oxidhaut des Aluminiums zerstört, ist das Mitführen von quecksilberhaltigen Geräten (z. B. Fieberthermometer) in Flugzeugen nicht verboten aber gemäß der IATA Dangerous Goods Regulations beschränkt (1 Stück / Passagier und zwingend in Schutzhülle – DGR 2.3). Quecksilber ist der Gefahrgutklasse 8 – Ätzende Materialien zugeordnet. Eine ätzende Wirkung besteht allerdings nur in Verbindung mit Aluminium – ein Leichtmetall, das im Flugzeugbau verwendet wird.
Desinfektions- und Beizmittel
In dem Wunddesinfektionsmittel Mercurochrom war der wirksame Bestandteil ein organisches Quecksilbersalz. Die heute erhältliche Mercuchrom-Jod-Lösung ist eine Povidon-Jod-Lösung. In Merfen, einem weiteren Desinfektionsmittel, war früher Phenylquecksilberborat enthalten. HgCl2 (Sublimat) wurde früher als Desinfektionsmittel in Krankenhäusern verwendet. Thiomersal besteht zur Hälfte (Masse) aus Quecksilber und wurde vor allem als Bakterizid bei Impfstoffen eingesetzt.
Die konventionelle Landwirtschaft verwendet Quecksilberverbindungen als Beizmittel für Saatgut. In Deutschland wurde die Verwendung von Quecksilber hierfür 1984 verboten.
Heilkunde
Im ausgehenden 19. Jahrhundert hielt man Quecksilber für ein geeignetes Medikament gegen Frauenleiden, weswegen es zum Teil in toxischen Mengen verabreicht wurde. Das Wort hat allerdings nichts mit Quacksalber zu tun, auch wenn der Klang dies nahe legt. Quacksalber kommt vielmehr aus dem Niederländischen (kwakzalver, wobei kvakken soviel wie „schwatzen“ oder „prahlen“ bedeutet).[11]
Bis zum Anfang des 20. Jahrhunderts war Quecksilbersalbe ein weit verbreitetes Mittel zur Behandlung der Syphilis.[12] Dazu wurde das Quecksilber in der Regel auf die Haut aufgetragen oder gelegentlich sogar inhaliert, wobei es in vielen Fällen zu Vergiftungserscheinungen kam. Syphilis galt als Volksseuche und Anspielungen auf die Symptome der Syphilis sowie der damit einhergehenden Quecksilbervergiftung finden sich in vielen literarischen Werken der damaligen Zeit.
Metallisches Quecksilber diente im gleichen Zeitraum zur Behandlung von Darmverschlüssen. Der Patient nahm dazu oral mehrere Kilogramm metallisches Quecksilber auf, um das Hindernis im Darm zu überwinden. Wenn er die Behandlung überlebte, verließ das Metall seinen Körper auf natürlichem Wege ohne weitere Vergiftungserscheinungen.[13]
Elektrolyse
Quecksilber spielt eine große Rolle bei der Herstellung von Natronlauge und Chlor nach dem Amalgamverfahren. Während der Elektrolyse wird das reduzierte Natriummetall als Amalgam, einer Natrium-Quecksilber-Legierung, in eine separate Zelle, den Zersetzer, überführt, um die Bildung des explosiven Chlorknallgases und des unerwünschten Natriummonooxochlorates (Natriumhypochlorit) in der Elektrolysezelle zu verhindern.
Goldwäsche
Bei der Goldwäsche wird Quecksilber verwendet, um den feinen Goldstaub zu lösen, wodurch Goldamalgam entsteht (siehe Amalgamation). Da Quecksilber schon bei niedrigen Temperaturen flüssig wird, bildet es Legierungen, die besonders leicht schmelzen. Beim Waschen und bei anschließendem Glühen zur Rückgewinnung reinen Goldes gelangt das Quecksilber in die Umgebung. Dies ist der Hauptgrund für die hohe Umweltverschmutzung bei dieser Art der Goldgewinnung.
Mit dieser Methode ist auch ein Vergolden von Kupferblechen möglich, was zum Beispiel bei den Kuppeln der Isaakskathedrale in Sankt Petersburg im 19. Jahrhundert angewendet wurde.
Früher wurde unter anderem im Harz auf diese Weise auch Silber gewonnen. Siehe auch: Amazonas.
Kunst
Im Grabmal des ersten chinesischen Kaisers soll es Flüsse aus Quecksilber gegeben haben. In der Umgebung hat man wissenschaftlich den Boden untersucht und dabei einen unnatürlich hohen Quecksilbergehalt festgestellt. Dieser allein ist aber noch kein Beleg für die Richtigkeit der Legende.
Der amerikanische Künstler Alexander Calder baute 1937 einen Quecksilber-Springbrunnen zum Gedenken an die Todesopfer des Quecksilberabbaus. Um das Jahr 1000 gab es in den Palästen der Kalifen von Córdoba (Medina az-Zahra), Kairo und Bagdad mit Quecksilber gefüllte Becken, die für das Spiel mit Lichtwirkungen genutzt wurden, außerdem in großen Porphyrmuscheln angelegte Quecksilberteiche (für Kairo sind 50 Ellen im Quadrat überliefert).
Sonstige Anwendungen
- Verwendung findet das Metall in Knopfzellen und Batterien. Mittlerweile gibt es jedoch nur noch einen Produzenten in Taiwan; der Import in die EU ist nicht mehr zulässig. Früher wurde es auch in manchen Röhren der Elektronik wie Quecksilberdampfgleichrichtern, Ignitrons, Excitrons, und Thyratrons verwendet.
- In manchen Ländern werden oder wurden quecksilber-organische Verbindungen zum Beizen von Saatgut verwendet. Dabei kam es im Irak 1971–1972 zu Massenvergiftungen infolge des Verzehrs von Saatgut.
- In der Astronomie wird Quecksilber zum Bau relativ preisgünstiger Teleskope mit großer Spiegelfläche verwendet (siehe Flüssiger Spiegel): Quecksilber wird in einen tellerförmigen, luftgelagerten Spiegelträger gefüllt, der dann in Rotation versetzt wird. Durch die Rotation verteilt sich das Quecksilber auf der gesamten Spiegelträgerfläche in dünner Schicht und bildet einen nahezu perfekten parabolischen Spiegel. Ein Nachteil dieser Teleskope ist, dass sie nur senkrecht nach oben schauen können, weil sonst das Quecksilber ausläuft.
- Die Eigenschaft von Quecksilber, sich wie eine nichtbenetzende Flüssigkeit zu verhalten (Ausnahmen: Amalgambildner wie Kupfer, Silber, Gold, Aluminium), ist Grundlage für die Quecksilber-Porosimetrie. Hierbei wird Quecksilber unter Druck (0 bis 4000 bar) in Poren unterschiedlicher Größe gedrückt. Über den aufgewendeten Druck und die dabei benötigte Quecksilbermenge können Aussagen über die Beschaffenheit, Form, Verteilung und Größe von Poren und Hohlräumen gemacht werden. Anwendung findet diese Methode unter anderem in der Mineralogie, Pharmazie und den Keramik-Wissenschaften.
- Früher wurden Quecksilbersalze von Hutmachern verwendet und insbesondere bei der Herstellung der im 18. Jahrhundert sehr modischen Filzhüte aus Biberfellen verwendet. Der englische Ausdruck mad as a hatter („verrückt wie ein Hutmacher“) (siehe auch Hutmachersyndrom) geht vermutlich auf die Anwendung zurück. Er wurde auch durch die Figur des verrückten Hutmachers in Lewis Carrolls Alice im Wunderland populär.
- Quecksilber wurde in der Vergangenheit neben Wasser als Arbeitsmittel in Dampfkraftwerken verwendet. Der Dampf des Metalles erreichte dabei eine Temperatur von 500 °C bei einem Druck von 10 bar. Trotz seiner thermodynamischen Vorteile setzte sich das Verfahren wegen der Giftigkeit des Metalles nicht durch.
- Quecksilber findet (bzw. fand vor allem in der Vergangenheit) auch Verwendung als Arbeitsmittel in Diffusionspumpen zur Erzeugung von ölfreiem Hochvakuum.
Laut Pressemitteilung vom 15. Januar 2009 entschied das Umweltministerium in Schweden, den Gebrauch von Quecksilber generell zu verbieten. Das Verbot bedeutet, dass der Gebrauch von Amalgam in Zahnfüllungen eingestellt wird und dass quecksilberhaltige Produkte nicht mehr in Schweden vermarktet werden dürfen. Andreas Carlgren, der schwedische Umweltminister, sagte: „Das Verbot ist ein starkes Signal für andere Länder und der Beitrag Schwedens zu den Zielen von EU und UN, Gebrauch und Emission von Quecksilber zu reduzieren.“ Die neuen Regelungen treten am 1. Juni 2009 in Kraft.[14]
Wichtige Quecksilberverbindungen
- Quecksilber(II)-amidchlorid (D0602Z)
- Quecksilber(I)-chlorid (Mineral Kalomel)
- Quecksilber(II)-chlorid (Sublimat)
- Quecksilber(II)-fulminat (Knallquecksilber)
- Quecksilber(II)-iodid (Neßler-Reaktion)
- Quecksilber(II)-nitrat
- Quecksilber(II)-oxid
- Quecksilber(II)-sulfid (Mineral Cinnabarit, Zinnober)
Nachweis
Als Nachweisreaktion für Quecksilbersalze wird die Amalgamprobe durchgeführt: Die salzsaure Lösung wird auf ein Kupferblech gegeben – zurück bleibt ein nicht abwischbarer, silbriger Amalgamfleck:

(Redoxreaktion: Quecksilberkationen oxidieren Kupferatome zu Kupferionen und werden selbst zu Quecksilberatomen reduziert; letztere bildet mit dem Kupferblech eine Legierung, Kupfer-Amalgam. Silbersalze bilden ebenfalls Flecke, jedoch ist das hier entstehende Silber fest und somit abwischbar; Silber wird daher besser mit Salzsäure als Chlorid gefällt, welches in verdünntem Ammoniak löslich ist; siehe oben).
Als weiterer Nachweis wird die Glühröhrchen oder Glührohrprobe verwendet. Dabei wird die zu analysierende Substanz mit etwa der gleichen Menge Natriumcarbonat (Soda) vermengt und im Abzug geglüht. Quecksilber scheidet sich dann als Tröpfchen an der Reagenzglaswand ab. Diese Tröpfchen kann man dann mit einem Papierröllchen zu kleinen Perlen verreiben.
Weitere Nachweise sind: Kalomel (Hg2Cl2) oder schmelzbares Präzipitat sowie unschmelzbares Präzipitat.
Die quantitative Bestimmung extrem winziger Quecksilberspuren ist mittels der Kaltdampftechnik in der Atomspektrometrie möglich. Als Nachweisgrenze wird dafür 0,001 µg/l (1 ppt) angegeben.[15] Für diesen Zweck kann man speziell entwickelte Quecksilberanalysatoren verschiedener Herstellerfirmen kaufen. Daneben kommt die Inversvoltammetrie an Gold-, Platin- oder Kohleelektroden in Frage[16].
Umweltemissionen
Quecksilber wird in großen Mengen durch menschliche Aktivitäten freigesetzt. Es wird geschätzt, dass jährlich etwa 2.200 t als gasförmiges Quecksilber in die Atmosphäre abgegeben werden, zudem noch erhebliche Mengen in Böden und Gewässer. Die größte Emissionsquelle ist die Kohleverbrennung. In Stein- und Braunkohle tritt Quecksilber zwar nur in Spuren auf, die hohe Menge der weltweiten verbrannten Kohle führt aber zu erheblichen Freisetzungsraten. Weitere bedeutsame Quellen sind Chlorproduktion, Zementwerke und die kleingewerbliche Goldgewinnung (Artisanal Small Scale Mining). Aufgrund der bekannten Gefahren freigesetzten Quecksilbers wird derzeit auf der Ebene des UN-Umweltprogramms (UNEP) diskutiert, ob ein eigenes internationales Abkommen mit dem Ziel der weltweiten Senkung der Emissionen verabschiedet werden soll.
Gesundheitsschäden durch Quecksilber
Siehe auch Quecksilbervergiftung
Quecksilber ist ein giftiges Schwermetall, das bereits bei Zimmertemperatur verdunstet. Bei der Aufnahme über den Verdauungstrakt ist Quecksilber vergleichsweise ungefährlich, eingeatmete Dämpfe wirken aber stark toxisch. Besonders toxisch sind vor allem die organischen Verbindungen des Quecksilbers, wenn sie mit der Nahrung aufgenommen werden. Je nach Aufnahme sind sowohl eine akute als auch eine chronische Vergiftung möglich. Als Beispiel kann der Fall des englischen Schiffes Triumph im Jahre 1810 dienen, auf dem sich mehr als 200 Menschen vergifteten, als ein Fass mit Quecksilber auslief.
In jüngerer Zeit (2007) sind ayurvedische Mittel mit hohen Quecksilbergehalten aufgefallen.[17]
Siehe auch
- Minamata-Krankheit (chronische Vergiftung durch Quecksilber)
- Hautaufhellung
- Thiomersal
Einzelnachweise
- ↑ Bild der Wissenschaft, 1/2008, Seite 13
- ↑ X. Wang, L. Andrews, S. Riedel, M. Kaupp, Angewandte Chemie 2007, 119, 8523.
- ↑ Eintrag zu CAS-Nr. 7439-97-6 im European chemical Substances Information System ESIS
- ↑ a b Deutsches Wörterbuch, Grimm, Jacob und Wilhelm, Leipzig, Verlag von S. Hirzel, Band 13
- ↑ Neue Zürcher Zeitung: Unkonventionelle Supraleiter und ihre Parallelen, 28. September 2005
- ↑ Werner Schröter, K. -H. Lautenschläger: Chemie für Ausbildung und Praxis, Verlag Harry Deutsch, Thun und Frankfurt am Main (1996) ISBN 3-8171-1484-2 Seite 314
- ↑ a b c d http://prola.aps.org/abstract/PR/v20/i3/p259_1
- ↑ a b c d e CRC_Handbook_of_Chemistry_and_Physics, 76th Edition, S. 6-77
- ↑ a b c d e f CRC_Handbook_of_Chemistry_and_Physics, 76th Edition, S. 6-110
- ↑ http://www.nfp-online.de/Meldung.61.0.html?&no_cache=1&tx_ttnews%5Btt_news%5D=57&tx_ttnews%5BbackPid%5D=44
- ↑ Etymologie-Duden. Mannheim 1963, S. 541.
- ↑ http://books.google.de/books?id=2pP-Y0_uerwC&dq=Quecksilbersalbe
- ↑ Fränztl, Enterotomie bei Ileus, in Virchows Archiv, 49/1870, S. 164–192. ISSN 0945-6317 (Print) ISSN 1432-2307 (Online)
- ↑ http://www.sweden.gov.se/sb/d/11459/a/118550
- ↑ K. Cammann (Hrsg.), Instrumentelle Analytische Chemie, Spektrum Akademischer Verlag, Heidelberg-Berlin, 2001, S. 4-47.
- ↑ R. Neeb, Inverse Polarographie und Voltammetrie, Akademie-Verlag, Berlin, 1969, S. 193-195.
- ↑ Ökotest, Nahrungsergänzung: Gift in Ayurveda-Produkten entdeckt., vom 1. März 2007
Literatur
- Günther Tölg, Irmgard Lorenz: Quecksilber – ein Problemelement für den Menschen? Chemie in unserer Zeit 11(5), S. 150–156 (1977), ISSN 0009-2851
- Klaus Brodersen: Quecksilber – ein giftiges, nützliches und ungewöhnliches Edelmetall. Chemie in unserer Zeit 16(1), S. 23–31 (1982), ISSN 0009-2851
- Fritz Schweinsberg: Bedeutung von Quecksilber in der Umweltmedizin – eine Übersicht. Umweltmedizin in Forschung und Praxis 7(5), S. 263–278 (2002), ISSN 1430-8681
- Ebinghaus, Ralf et al.: Mercury Contaminated Sites – Characterization, Risk Assessment and Remediation. Springer Verlag, Berlin 1999, ISBN 3-540-63731-1
- Watras, Carl J. and Huckabee, John W.: Mercury Pollution – Integration and Synthesis. Lewis Publishers, Ann Arbor 1994, ISBN 1-56670-066-3
- Joachim Strähle, Eberhard Schweda: "Lehrbuch der analytischen und präparativen anorganischen Chemie" Jander Blasius, S.466, 16. Auflage, S. Hirzel Verlag 2006, ISBN 3-7776-1388-6
Weblinks
- Mineralienatlas – Quecksilber
- ALLUM: Gute, verständliche Informationen zum Thema Quecksilber
- Liquid Mirror Telescope – Teleskopspiegel aus Quecksilber
- Handlungsanweisung bei zerbrochenem Quecksilberthermometer
- Fachmann fragen
- Mercury and Human Health, Environmental Health & Toxicology, Specialized Information Services, National Library of Medicine (en.)
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga As Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Te I Xe Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Rn Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Uub Uut Uuq Uup Uuh Uus Uuo
Alkalimetalle Erdalkalimetalle Lanthanoide Actinoide Übergangsmetalle Metalle Halbmetalle Nichtmetalle Halogene Edelgase
Wikimedia Foundation.