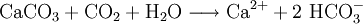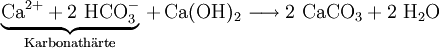- Härtebereich
-
 Wasserhahn mit Strahlregler: Hier ist die Härte des Leitungswassers sichtbar an der Kalkablagerung, die am tropfenden Hahn zurückbleibt.
Wasserhahn mit Strahlregler: Hier ist die Härte des Leitungswassers sichtbar an der Kalkablagerung, die am tropfenden Hahn zurückbleibt.Wasserhärte ist ein Begriffssystem der angewandten Chemie, das sich aus den Bedürfnissen des Gebrauchs natürlichen Wassers mit seinen gelösten Inhaltsstoffen entwickelt hat. Konkret wird mit Wasserhärte die Äquivalentkonzentration der im Wasser gelösten Ionen der Erdalkalimetalle, in speziellen Zusammenhängen aber auch deren anionischer Partner bezeichnet. Zu den „Härtebildnern“ zählen im Wesentlichen Calcium- und Magnesiumionen sowie in Spuren Strontium- und Bariumionen. Die gelösten Härtebildner können unlösliche Verbindungen bilden, vor allem Kalk und sogenannte Kalkseifen. Diese Tendenz zur Bildung von unlöslichen Verbindungen ist der Grund für die Beachtung der gelösten Erdalkalien, die zur Entstehung des Begriffs- und Theoriesystems um die Wasserhärte geführt hat.
- Weiches Wasser ist günstiger für alle Anwendungen, bei denen das Wasser erhitzt wird, zum Waschen, zum Gießen von Zimmerpflanzen etc. Nachteilig ist jedoch die starke Schaumbildung bei Waschmitteln und die schlechte Entfernbarkeit von Seife z. B. beim Händewaschen. Weiches Wasser steht in Kristallin-Regionen mit Granit, Gneis, Basalt und Schiefer-Gesteinen zur Verfügung. Auch Regenwasser ist weich.
- Hartes Wasser führt zur Verkalkung von Haushaltsgeräten, erhöht den Verbrauch von Spül- und Waschmitteln, beeinträchtigt oder fördert, je nach dem Maß der Härte, den Geschmack und das Aussehen empfindlicher Speisen und Getränke (z. B. Tee). Hartes Wasser kommt aus Regionen, in denen Sand- und Kalkgesteine vorherrschen.
Inhaltsverzeichnis
Unterteilung in Härte-Anteile
Was man unter dem Begriff Wasserhärte subsumiert, ist ein System verschiedener miteinander gekoppelter chemischer Gleichgewichte. Diese sind zum einen die Löslichkeitsgleichgewichte zwischen den verschiedenen Erdalkali-Ionen und den zugehörigen Carbonat- und Sulfat-Fällungsprodukten (Calcit, Dolomit, Schwerspat, Gips etc.). Untrennbar damit gekoppelt ist zum anderen das Lösungs- und Dissoziationgleichgewicht des Kohlenstoffdioxid-Kohlensäure-Carbonat-Systems. Die im Folgenden dargestellte gängige Einteilung der Härte in verschiedene Unterbegriffe greift einzelne Teilaspekte dieses komplexen Gleichgewichtssystems heraus und benennt jeweils deren quantitativen Anteil.
Die Gesamthärte gibt die Summe der Konzentrationen der Kationen von Erdalkalimetallen in Wasser an. Diese Kationen haben eine große, positive physiologische Bedeutung, stören jedoch bei einigen Verwendungen des Wassers. So bilden ins Wasser eingebrachte Seifen mit diesen Kationen unlösliche Kalkseifen, die über keine Reinigungswirkung mehr verfügen. Beim Waschen von Textilien in Wasser mit hoher Gesamtwasserhärte führen die Kalkseifen zu einer Verunreinigung der Textilen. Seifen zählen zu den anionischen Tensiden und sind besonders empfindlich gegenüber hartem Wasser. Die Waschleistung von anderen, modernen Tensiden in Waschmitteln wird dagegen kaum von der Wasserhärte beeinträchtigt. Trotzdem enthalten die Waschmittel zu etwa 30 % Substanzen, die hartes Wasser enthärten. (siehe auch Baukastenwaschmittel und Wasserhärte und Waschen)
In Bezug auf die Wasserhärte ist die Konzentration des Anions Hydrogencarbonat (HCO3−) von spezieller Bedeutung. Man bezeichnet die Konzentration an Hydrogencarbonationen bzw. den hierzu äquivalenten Teil der Erdalkalimetallionen als Carbonathärte, temporäre Härte oder vorübergehende Härte. Ein Wasser befindet sich im sogenannten Kalkkohlensäure-Gleichgewicht, wenn es gerade soviel Kohlenstoffdioxid, enthält, dass es gerade keinen Kalk abscheidet, aber auch keinen Kalk lösen kann. Wird einem solchen Wasser Kohlenstoffdioxid entzogen, bilden sich schwer lösliche Verbindungen wie Calcit und Dolomit als besonders schwer lösliches Mischcarbonat (Kesselstein, Seekreide). Das hängt von dem komplexen temperaturabhängigen Calciumcarbonat-Kohlensäure-Kohlenstoffdioxid-Gleichgewicht (oft vereinfacht als Kalk-Kohlensäure-Gleichgewicht bezeichnet) ab. Aufgrund der Temperaturabhängigkeit dieses Gleichgewichtssystems bilden sich auch Ablagerungen bei der Bereitung von Heißwasser (Warmwasseranlagen, Kaffeemaschinen, Kochtöpfe). In den Gewässern findet ein entsprechender Prozess als „biogene Entkalkung“ in Folge des durch die Photosynthese von Wasserpflanzen und Planktonalgen verursachten Verlustes an Kohlenstoffdioxid statt.
Als Nichtcarbonathärte oder auch permanente Härte oder bleibende Härte bezeichnet man den Teil der Gesamtwasserhärte, der nicht an Hydrogencarbonat bzw. Carbonat gebunden ist und daher prinzipiell nicht als Calcium- oder Magnesiumcarbonat aus dem Wasser entfernt werden kann. Dieser nicht entfernbare Anteil ist durch Anionen wie z. B. Chloride, Nitrate und Sulfate ausgeglichen („gebunden“). In welchen unterschiedlichen Konzentrationen diese Anionen genau vorliegen, spielt in Bezug auf die Wasserhärte keine Rolle, gibt aber Auskunft über die Herkunft dieser Anteile. Tatsächlich beeinflusst aber diese permanente Härte ganz entscheidend das Fällungsverhalten der Carbonathärte-Anteile, weil die somit erhöhten Konzentrationen an Calcium und Magnesium in die Rechnung der Ionenprodukte mit dem Carbonat eingehen und somit die Schwellenwerte z. B. der „zugehörigen Kohlensäure“ für das Eintreten der härtetypischen Fällungsreaktionen erhöhen.
Oft werden auch die Konzentrationen von Magnesium- und Calciumionen getrennt bestimmt und dann als „Magnesiumhärte“ bzw. „Calciumhärte“ bezeichnet. Ihre Summe entspricht in guter Näherung der Gesamtwasserhärte.
Einheiten und Umrechnungsfaktoren
Nach dem SI-Maßsystem wird der Gehalt der Erdalkaliionen, also die Gesamthärte in Mol pro Liter, bzw. angesichts der geringen Konzentrationen in Millimol pro Liter (mmol/l) angegeben.
Die Wasserhärte wurde früher in Grad deutscher Härte (°dH) angegeben. Dabei war 1 °dH formal als 10 mg CaO je einem Liter Wasser definiert. Die anderen Härtebildner wie Magnesium wurden als hierzu äquivalente Menge (7,19 mg MgO pro Liter) definiert. Später wurde die Angabe der Wasserhärte in der praxisgerechten Stoffmengen-Äquivalenzeinheit Millival pro Liter (mval/l) verwendet. Heute sind gesetzlich die oben genannten molaren Angaben gefordert, ungeachtet der praktischen Erfordernisse.
In anderen Ländern waren oder sind andere Maßeinheiten in Gebrauch, die jedoch nur eingeschränkt vergleichbar sind. Vergleichbar werden sie, wenn man ein Standard-Ionenverhältnis annimmt. Das ist möglich, weil die meisten natürlichen Wässer eine relativ ähnliche Kationenverteilung aufweisen, unabhängig vom Gesamtsalzgehalt. Nur unter dieser Voraussetzung ist die folgende Tabelle zur Umrechnung anwendbar:
Umrechnung für die Einheiten der Wasserhärte[1] °dH °e °fH ppm mval/l mmol/l Deutsche Grad 1 °dH = 1 1,253 1,78 17,8 0,357 0,1783 Englische Grad 1 °e = 0,798 1 1,43 14,3 0,285 0,142 Französische Grad 1 °fH = 0,560 0,702 1 10 0,2 0,1 ppm CaCO3 (USA) 1 ppm = 0,056 0,07 0,1 1 0,02 0,01 mval/l Erdalkali-Ionen 1 mval/l = 2,8 3,51 5 50 1 0,50 mmol/l Erdalkali-Ionen 1 mmol/l = 5,6 7,02 10,00 100,0 2,00 1 Die Einheit 1 ppm wird hier entgegen dem eigentlichen Wortsinn im Sinne von 1 mg/L CaCO3 verwendet.
Entstehung der Wasserhärte
Die Wasserhärte entsteht beim Durchtritt von Wasser durch Böden und/oder Grundwasserleiter (Aquifere). Deshalb hängt es stark vom geologischen Untergrund ab, welche und wie viel Härtebildner in Lösung gehen können. Dem entspricht die geografische Verteilung der Wasserhärte.
Magnesium- und Calciumionen können am einfachsten durch den Lösungsvorgang in das Wasser gelangen, etwa durch Auflösungen von Gips (CaSO4 × 2 H2O). Grundwässer aus gipshaltigen Schichten können im Extremfall die Sättigungskonzentration für Gips erreichen, die einer Härte von 78,5 °dH entspricht.
Der überwiegende Teil der Wasserhärte entsteht jedoch normalerweise als Carbonathärte durch Auflösung von Kalk (CaCO3) bzw. Dolomit (Ca-Mg-Mischcarbonat) durch Kohlensäure unter Bildung löslicher Hydrogencarbonate (HCO3−). Das CO2 stammt überwiegend aus der Atmung der Organismen im Boden, wo vor allem der mikrobielle Abbau organischer Substanz erhöhte CO2-Konzentrationen liefert.
Beispielsweise folgt die Auflösung reinen Kalksteins folgender Summenformel:
Daneben können auch die in saueren Niederschlägen enthaltenen Säuren, die durch den Begriff saurer Regen bekannt geworden sind, ebenfalls zu einem Härteanstieg führen. Beteiligt sind vor allem Schwefelsäure (H2SO4), die über Schwefeldioxid und die Bildung von Schwefeliger Säure bei der Verbrennung schwefelhaltiger Brennstoffe entsteht, und Salpetersäure (HNO3), die über die Zwischenstufe der Stickoxide bei besonders heißen Verbrennungen gebildet wird. Durch Maßnahmen zur Luftreinhaltung (z. B. Rauchgasentschwefelung und die Auspuffkatalysatoren) sind diese Belastungen in den vergangenen Jahrzehnten drastisch reduziert worden.
Beim Zerfall von Pflanzenmasse (tote Wurzeln, Falllaub, untergepflügte Halme) im Boden oder bei der Ausbringung landwirtschaftlichen Düngers wird der darin enthaltene Stickstoff zunächst als Ammonium (NH4+) freigesetzt. Daran schließt sich ein bakterieller Oxidationsprozess an, die sog. Nitrifikation. Das Ammonium wird zuerst zu Salpetriger Säure (HNO2) und schließlich zu Salpetersäure (HNO3) oxidiert. Diese Salpetersäure löst aus Kalk – und beim Fehlen von Kalk aus Tonmineralen – Härtebildner auf. Deshalb drohen landwirtschaftlich genutzte Böden ohne Kalk zu versauern. In diesen Fällen ist eine Kalkdüngung erforderlich. Auch diese kann für den Härteanstieg in Grundwässern mitverantwortlich sein.
In Grundwässern, die durch landwirtschaftliche Aktivitäten beeinflusst sind, kann die Härte auf über 30 °dH, in Einzelfällen sogar auf über 40 °dH, ansteigen. Dies geht sowohl auf vermehrte Kohlensäurebildung als auch auf vermehrte Nitrifikation zurück.
Regenwasser kann nur ausnahmsweise dann Härtebildner aufnehmen, wenn die Atmosphäre kalkhaltige Staubpartikel enthält. Üblicherweise liegt deshalb die Härte von Regenwasser nahe Null. Auch Trinkwasser-Talsperren und Bergseen enthalten selbst in kalkreichen Gegenden oft Wasser von geringer Härte, wenn ihr Einzugsgebiet eine geringe geografische Fläche umfasst und das Regenwasser hauptsächlich oberflächlich zufließt.
Physiologische Bedeutung
Magnesium und Calcium sind für den Organismus essentiell. Der menschliche Körper enthält 470 mg/kg Magnesium und 15 g/kg Calcium. Für die Versorgung des Körpers mit diesen Elementen spielt das Trinkwasser jedoch eine untergeordnete Rolle. Strontium ist ebenso wie Calcium in den Knochen enthalten, hat aber keine spezielle physiologische Bedeutung. Barium ist in gelöster Form giftig. In sulfathaltigen Wässern werden toxikologisch bedenkliche Konzentrationen aber nicht erreicht, weil das extrem schwerlösliche Bariumsulfat gebildet wird.
Bestimmung der Wasserhärte
- Die bekannteste praktikable Bestimmungsmethode für die Gesamthärte ist die komplexometrische Titration mit einer wässrigen Lösung des Dinatriumsalz der Ethylendiamintetraessigsäure (EDTA, Handelsname: Titriplex III) mit bekannter Konzentration. EDTA bildet mit den Härtebildnern Ca2+ und Mg2+ lösliche, stabile Chelatkomplexe. 100 ml der zu untersuchenden Wasserprobe werden mit 2 ml 25 %-iger Ammoniaklösung, einem pH 11 Puffer (Ammoniak-Ammoniumacetat) und dem Indikator Eriochromschwarz-T versetzt. Üblicherweise ist der Indikator mit dem Puffer zusammen als so genannte „Indikator-Puffer-Tabletten“ erhältlich. Der Indikator bildet mit den Ca2+ und Mg2+ einen rot gefärbten Komplex. Sind diese Ionen am Ende der Titration vom EDTA gebunden, liegt das Eriochromschwarz-T frei vor und ist grün gefärbt. Die Gesamthärte berechnet sich aus den verbrauchten ml EDTA-Lösung. Bei einer Wasserprobe von 100 mL entspricht 1 ml verbrauchter EDTA-Lösung (c = 0,1 mol/l) 5,6 °dH (Deutsche Härtegrade), das entspricht 1 mmol/l Erdalkalionen. Um die Calcium- und Magnesiumkonzentration einzeln nachzuweisen wird bei einem niedrigeren pH von ca. 8 erst gegen Ca2+ mit EDTA titriert, weil bei diesem pH der Mg-EDTA-Komplex noch nicht stabil ist. Am Umschlagspunkt von Calcium wird der pH dann auf 11 eingestellt und mit EDTA gegen Mg2+ titriert.
- Die Carbonathärte wird durch das Salzsäure-Bindungs-Vermögen (SBV) bestimmt. Hierzu werden 100 ml des Wassers mit Salzsäure (c = 0,1 mol/l) bis zum pH-Wert 4,3 titriert (pH-Meter oder Umschlag von Methylorange-Indikator). Hierbei wird (nahezu) alles Carbonat und Hydrogencarbonat zu „freier Kohlensäure“ umgewandelt. Der Säureverbrauch in ml entspricht deshalb der Hydrogencarbonatkonzentration in mval/l. Die Multiplikation mit 2,8 ergibt deutsche Härtegrade (°dH), sofern das Ergebnis der Berechnung nicht die Gesamthärte übersteigt. Resultiert bei der Analyse eines natürlichen Wassers für die Carbonathärte ein höherer Wert als für die Gesamthärte, so enthält dieses Wasser auch Natriumhydrogencarbonat. Die Carbonathärte ist in diesem Fall identisch mit der Gesamthärte, da diese nicht größer als die Gesamthärte sein kann.
- In analytischen Labors können die Erdalkaliionen wie auch die Anionen der Säurereste mit Hilfe der Ionenchromatografie oder der Kapillarelektrophorese bestimmt werden. Calcium kann auch spektroskopisch mit Hilfe der Flammen-Atomemissionsspektrometrie bestimmt werden.
Eignung zum Waschen
Auf Verpackungen von Wasch- und Reinigungsmitteln, die Phosphate oder andere härtebindende Stoffe enthalten, mussten nach §7 Abs. 1 Satz 1 Nr. 5 WRMG (Wasch- und Reinigungsmittelgesetz aus dem Jahr 1987, BGBl. I S. 875 [2]) seit 1988 abgestufte Dosierungsempfehlungen in Millilitern für die Härtebereiche 1 bis 4 angegeben werden. Gesetzlich vorgegeben waren dabei die Angaben bezüglich Millimol Gesamthärte je Liter. Es wurden die folgenden Härtebereiche definiert:
Härtebereich Millimol Gesamthärte je Liter °dH 1 (weich) bis 1,3 bis 7,3 2 (mittel) 1,3 bis 2,5 7,3 bis 14 3 (hart) 2,5 bis 3,8 14 bis 21,3 4 (sehr hart) über 3,8 über 21,3 - Regelung für Deutschland seit Mai 2007
Am 1. Februar wurde vom deutschen Bundestag die Neufassung des Wasch- und Reinigungsmittelgesetzes [3] (WRMG) beschlossen, das am 5. Mai in Kraft getreten ist. Darin wurden u. a. die Härtebereiche an europäische Standards angepasst und die Angabe Millimol Gesamthärte je Liter wird durch die (aus chemischer Sicht unsinnige) Angabe Millimol Calciumcarbonat je Liter ersetzt. Wasserversorgungsunternehmen werden wohl weiterhin auch die Gesamthärte veröffentlichen, dies ist im Gesetz aber nicht vorgeschrieben. Nach Stellungnahmen des BMU gegenüber der DVGW [4] soll Millimol Calciumcarbonat je Liter unverändert als Millimol Gesamthärte je Liter aufgefasst werden. Die neuen Härtebereiche unterscheiden sich kaum von den bisherigen, nur werden die Bereiche 3 und 4 zum Härtebereich „hart“ zusammengelegt und die Ziffern 1,2,3 und 4 werden durch die, bereits benutzten, Beschreibungen „weich“, „mittel“ und „hart“ ersetzt. Die neuen Härtebereich sind wie folgt definiert:
Härtebereich Millimol Calciumcarbonat je Liter °dH weich weniger als 1,5 weniger als 8,4 °dH mittel 1,5 bis 2,5 8,4 bis 14 °dH hart mehr als 2,5 mehr als 14 °dH Auf Verpackungen von Waschmitteln müssen laut §8 Abs. 1 Satz 1 WRMG[5] empfohlene Mengen und/oder Dosierungsanleitung in Milliliter oder Gramm für eine normale Waschmaschinenfüllung bei den Wasserhärtegraden weich, mittel und hart und unter Berücksichtigung von ein oder zwei Waschgängen angegeben werden. Um Waschmittel einzusparen muss man die örtlich vorhandene Wasserhärte kennen und liest dann auf der Packung die dazu gehörende Waschmittelmenge ab. Generell benötigt man nur die für den Härtebereich 1 empfohlene Waschmittelmenge. Bei härterem Trinkwasser (ab Härtebereich 3) sollte man bei Temperaturen ab 60 °C einen separaten, phosphatfreien Enthärter dazugeben. Die Wasserversorgungsunternehmen teilen dem Kunden die örtliche Wasserhärte mit oder verschicken Aufkleber, welche man zweckmäßigerweise auf die Waschmaschine klebt.
Für Trinkwasser bestehen Vorschriften bezüglich der Wasserhärte, siehe dort.
Entfernung der Wasserhärte
→ Hauptartikel: Wasserenthärtung
Entkarbonisierung: Mit dieser Maßnahme wird nur die Karbonathärte verringert. Dem Wasser wird Calciumhydroxid als „Kalkwasser“ zugegeben, das die folgende Reaktion auslöst:
Eine Entkarbonisierung wird in einigen deutschen Wasserwerken an sehr harten Wässern durchgeführt.
Enthärtung durch Ionenaustausch: Ionenaustauscher, die mit Kochsalz regeneriert werden, sind in der Lage, Calcium- und Magnesiumionen gegen Natriumionen auszutauschen. Dieses Prinzip wird z. B. in Spülmaschinen eingesetzt, um die Heizelemente zu schonen und „Kalkflecken“ auf dem Geschirr zu vermeiden. Gelegentlich wird es auch zur Aufbereitung kleiner Wassermengen, etwa zum Blumen gießen oder Tee kochen, verwendet.
Vollentsalzung: Eine Vollentsalzung beseitigt nicht nur Härtebildner sondern alle Ionen. Sie wird durch eine Kombination von Kationen- und Anionenaustauscher erreicht. Vollentsalztes Wasser wird überall da eingesetzt, wo Wasser in reiner Form benötigt wird. Die größten Mengen kommen als Kesselspeisewasser zum Einsatz. Ein ähnliches Ergebnis erzielen die Umkehrosmose und die Destillation, bei denen auch nichtionische gelöste Feststoffe entfernt werden.
Andere Methoden: Die Komplexbildung mit Polyphosphaten vermindert die Härte, führt jedoch zur Überdüngung von Oberflächengewässer. Waschmittel enthalten oft noch in kleinen Mengen Komplexbildner, die Enthärtung erfolgt jedoch heute im wesentlichen durch Kationenaustauscher wie Zeolith A. Damit werden die Bildung von Kalkseifen verhindert, die Stabilität der für den Waschgang notwendigen Emulsion erhöht und die Heizelemente der Waschmaschine geschont.
Bei Dampflokomotiven wird auch die Innere Speisewasseraufbereitung verwendet.
Geräte mit elektrischen oder magnetischen Feldern führen zu keiner Beseitigung der Härte und ihre Wirkung ist mehr als umstritten.[6] Bestenfalls ist denkbar, dass bei der Kristallisation des überschüssigen Calciumcarbonates unter dem Einfluss dieser Felder die instabile Aragonit-Form gebildet wird, die aus feinen nadelförmigen Kristallen besteht und suspendiert bleibt. Die normale Kristallisation zu dem stabileren Calcit dagegen bildet die bekannten Verkrustungen (Kesselstein). Die Wirkung dieser Art von Wasserbehandlung ist zeitlich begrenzt und geht deshalb nach einer gewissen Fließstrecke hinter dem Gerät wieder verloren. Eine Voraussetzung für die beschriebene Wirkung scheint zu sein, dass Wechselfelder benutzt werden oder das Wasser in einem statischen Feld verwirbelt wird. Deshalb bleiben z. B. auf die Wasserleitung aufgesetzte Magnetschuhe ohne jede Wirkung.
Literatur und Einzelnachweise
- Walter Kölle: Wasseranalysen – richtig beurteilt. 2. Auflage, WILEY-VCH, 2003, ISBN 3-527-30661-7
- Hanns-J. Krause: Handbuch Aquarienwasser. bede-Verlag, Kollnburg 1993, ISBN 3-927997-00-5
- ↑ Tabelle nach: Krause, Seite 35
- ↑ Bundesgesetzblatt Jahrgang 1987 Teil I Nr. 20 (PDF-Datei)
- ↑ Wasch- und Reinigungsmittelgesetz vom 29. April 2007 (BGBl. I S. 600)
- ↑ Neue Härtebereiche für Trinkwasser
- ↑ i. Verb. m. der EG-Verordnung Nr. 648/2004[1] (zuletzt geändert durch EG-Verordnung Nr. 907/2006[2]) Art. 11 Abs. 4 und gemäß Anhang VII Abschnitt B derselben
- ↑ Kalk - das Gespenst in der Wasserleitung, Stephan Matthiesen, Ralph Puchta, Der Skeptiker 10 (1997) 49-51.
Weblinks
Wikimedia Foundation.