- AmO2
-
Kristallstruktur 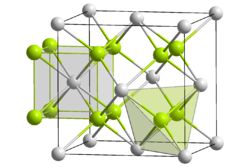
Am4+: __ O2-: __ Kristallsystem kubisch Raumgruppe 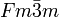
Koordinationszahlen Am[8], O[4] Allgemeines Name Americium(IV)-oxid Andere Namen Americiumdioxid
Verhältnisformel AmO2 CAS-Nummer 12005-67-3 Kurzbeschreibung schwarzer Feststoff[1] Eigenschaften Molare Masse 275,06 g/mol[1] Aggregatzustand fest
Dichte 11,68 g/cm3[1]
Schmelzpunkt 1000 °C (Zersetzung)[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [2] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Radioaktivität 
RadioaktivSoweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Americium(IV)-oxid ist ein Oxid des Elements Americium. Es besitzt die Summenformel AmO2.
Inhaltsverzeichnis
Vorkommen
Da alle Isotope des Americiums nur künstlich hergestellt sind, besitzt Americium(IV)-oxid keine natürlichen Vorkommen. Americium(IV)-oxid ist die wichtigste Verbindung dieses Elements. Nahezu alle Anwendungen dieses Elements basieren auf dieser Verbindung. Sie entsteht unter anderem implizit in Kernreaktoren beim Bestrahlen von Urandioxid (UO2) bzw. Plutoniumdioxid (PuO2) mit Neutronen.
Darstellung
Für Kleinstmengen bietet sich das Glühen von Salzen des Americiums an. Meistens werden hierzu Americium(III)-oxalat (Am2(C2O4)3) oder Americium(III)-nitrat (Am(NO3)3) herangezogen. Die Americium(III)-nitratlösungen werden eingedampft und dann bei 1000 °C zum Oxid geglüht.[3] Ebenso verfährt man mit gefälltem Americium(III)-oxalat und anschließendem Glühen bei 900 °C.
Eigenschaften
Americium(IV)-oxid ist ein schwarzer Feststoff. Es kristallisiert im kubischen Kristallsystem, der Strukturtyp ist der CaF2-Typ (Fluorit) mit der Raumgruppe
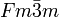 und den Koordinationszahlen Am[8], O[4].
und den Koordinationszahlen Am[8], O[4].Verwendung
Americium(IV)-oxid (mit dem Isotop Americium 241Am) wird als Quelle für ionisierende Strahlung eingesetzt. Anwendungsgebiete sind die Fluoreszenzspektroskopie und als Ionisationsrauchmelder.
Einzelnachweise
- ↑ a b c d Americium(IV)-oxid bei www.webelements.com.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Sherman Fried: "The Preparation of Anhydrous Americium Compounds", in: J. Am. Chem. Soc., 1951, 73 (1), 416–418; doi:10.1021/ja01145a135.
Literatur
- Norman N. Greenwood, Alan Earnshaw: Chemie der Elemente, 1. Auflage, Wiley-VCH, Weinheim 1988, ISBN 3-527-26169-9.
- Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, de Gruyter, Berlin 2007, S. 1972; ISBN 978-3-11-017770-1.
- Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements: Bd. 3, 2006, Springer.
Wikimedia Foundation.

