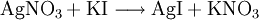- Jodsilber
-
Kristallstruktur 
__ Ag+ __ I- Allgemeines Name Silberiodid Andere Namen - Iodsilber
- Jodargyrit (Mineral)
Verhältnisformel AgI CAS-Nummer 7783-96-2 PubChem 24563 Kurzbeschreibung gelbliches, geruchloses Pulver Eigenschaften Molare Masse 234,77 g/mol Aggregatzustand fest
Dichte 5,67 g/cm3[1]
Schmelzpunkt 552 °C[1]
Siedepunkt 1506 °C[1]
Löslichkeit praktisch unlöslich in Wasser: 30 µg/l [1]; löslich in starken Komplexbildnern (Cyanide/Thiocyanate)
Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: 22-24/25 MAK 0,01 mg/m3 (bezogen auf die einatembare Fraktion)[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Silberiodid (auch: Silberjodid) ist eine chemische Verbindung aus Silber und Iod. Es ist ein gelbliches, in Wasser unlösliches Salz.
Inhaltsverzeichnis
Vorkommen
Natürlich kommt Silberiodid als Mineral Jodargyrit vor.
Gewinnung und Darstellung
Silberiodid wird durch Ausfällen aus einer Silbernitrat-Lösung mit Hilfe von Kaliumiodid gewonnen.
Diese Reaktion wird auch in der chemischen Analytik als Nachweis für Iodid-Ionen benutzt, weil das entstehende AgI einen schwerlöslichen gelblichen Niederschlag bildet. Im Gegensatz zum Silberiodid lassen sich das ebenfalls schwer lösliche Silberchlorid (AgCl) und Silberbromid (AgBr) in Natriumthiosulfat lösen (Komplexbildungsreaktion). Chlorid-, Bromid- und Iodid-Ionen können so mit Hilfe von Natriumthiosulfat und Ammoniaklösung voneinander unterschieden werden.
Eigenschaften
Physikalische Eigenschaften
Von Silberiodid sind mehrere Modifikationen bekannt.[2] Bei Raumtemperatur ist das β-AgI thermodynamisch stabil, das in der Wurtzit-Struktur kristallisiert. Daneben existiert eine metastabile Modifikation, das γ-AgI, das eine Zinkblende-Struktur hat.
Oberhalb von etwa 147 °C ist das α-AgI stabil, das aufgrund seiner hohen Silberionen-Leitfähigkeit zu den festen Ionenleitern gehört. Seine ionische Leitfähigkeit liegt in der Größenordnung von 1 bis 2 S/cm [3] und ist vergleichbar mit der von Flüssigelektrolyten. Das α-AgI hat ein kubisch-innenzentriertes Iodid-Untergitter und ein strukturell fehlgeordnetes Silberionen-Untergitter. Die Silberionen können sich also zwischen den größeren Iodidionen frei bewegen. Durch Einlagerung von Rubidium-Ionen zum Rubidiumsilberiodid (Ag4RbI5) kann die Temperatur des α/β-Phasenüberganges auf unter Raumtemperatur gesenkt werden. Dadurch wird auch der Bereich der Ionenleitung bis auf Raumtemperatur ausgedehnt.
Die elektronische Leitfähigkeit von α-AgI beruht auf Elektronen-Lochleitung und ist proportional zum I2-Partialdruck. Sie ist gegenüber der auf den Silberionen beruhenden Leitfähigkeit um ungefähr den Faktor 1010 kleiner.[4] Dies macht Silberiodid als festen Elektrolyten besonders gut geeignet.
Chemische Eigenschaften
Silberiodid ist lichtempfindlich und zerfällt dabei langsam in die Elemente. An Sonnenlicht verfärbt es sich grün-grau. AgI löst sich in starken Komplexbildnern, wie Cyaniden oder Thiocyanaten.
Verwendung
Silberiodid wird mit Aceton gemischt aus Hagelfliegern versprüht, um in der Atmosphäre kleinste Kondensationskerne zur gezielten Regen- oder Hagelbildung zu erzeugen. Damit kann die Bildung von zu großen Hagelkörnern verhindert werden. Bei den Olympischen Sommerspielen in Peking 2008 wurde Silberiodid mit Hilfe von Raketen in Regenwolken eingebracht, um diese an der Störung der Eröffnungsfeierlichkeiten zu hindern [5]. In den USA wurde in den 1940er und 1950er Jahren versucht, mit Silberiodid Hurrikane vorzeitig abzuschwächen, die Wirkung war allerdings eingeschränkt.[6] In Deutschland wurde 1958 im Landkreis Rosenheim eine organisierte Hagelabwehr eingerichtet, die das Silberiodid aus über 100 Abschussstellen durch Raketen in die Wolken schoss.[6] Seit 1975 wird diese Aufgabe von zwei Anti-Hagel-Flugzeugen erledigt.[6]
In den Anfangszeiten der Fotografie im 19. Jahrhundert wurde es wegen seiner Lichtempfindlichkeit für verschiedene Edeldruckverfahren wie Talbotypie, Kalotypie und Argyrotypie verwendet. Später wurde es durch besser geeignete Substanzen wie Silberbromid ersetzt.
Außerdem dient es dazu, Trinkwasser zu sterilisieren, wobei auf Grund seiner toxischen Wirkung ein bestimmter Grenzwert nicht überschritten werden darf.
Quellen
- ↑ a b c d e f Eintrag zu Silberiodid in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 21. Januar 2007 (JavaScript erforderlich)
- ↑ J. G. P. Binner, G. Dimitrakis, D. M. Price, M. Reading, B. Vaidhyanathan: "Hysteresis in the β–α Phase Transition in Silver Iodide", Journal of Thermal Analysis and Calorimetry 2006, 84, S. 409–412 [1]
- ↑ W. Biermann, W. Jost: Z. Phys. Chem. N. F. 1960, 25, S. 139
- ↑ B. Ilschner: J. Chem. Phys. 1958, 28, S. 1109
- ↑ http://www.spiegel.de/wissenschaft/natur/0,1518,569361,00.html
- ↑ a b c Mara Schneider: Das Wetter lässt sich nur bedingt kontrollieren. news.de, 19.02.2009. Abgerufen am 21.02.2009. (Nachrichtenartikel, Deutsch)
Wikimedia Foundation.