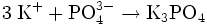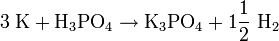- K3PO4
-
Strukturformel 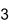
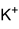
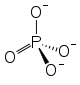
Allgemeines Name Kaliumphosphat Andere Namen Trikaliumphosphat
Summenformel K3PO4 CAS-Nummer 7778-53-2 PubChem 62657 Eigenschaften Molare Masse 212,28 g · mol−1 Aggregatzustand fest
Dichte 2,564 g · cm−3[1]
Schmelzpunkt Löslichkeit Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Reizend (Xi) R- und S-Sätze R: 36/38 S: 26 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Kaliumphosphat ist das Kaliumsalz der Phosphorsäure. Es wird hauptsächlich in Waschmitteln verwendet.
Inhaltsverzeichnis
Gewinnung/Darstellung
Kaliumphosphat entsteht auch bei dem Erhitzen von Thomasschlacke mit Kohle und Kaliumsulfat.
Eigenschaften
Kaliumphosphat löst sich in Wasser unter alkalischer Reaktion.
Herstellung
Es ist nicht möglich, durch Kristallisation wasserfreies Kaliumphosphat zu gewinnen, jedoch erhält man durch Einleitung von Ammoniak in die Lösung das reine Oktahydrat.[2]
Verwendung
Phosphate werden als Zusatz in Waschmitteln verwendet. Sie sind in der Lage, durch Komplexbildung mit mehrwertigen Metallionen (Mg2+ etc.) die Wasserhärte herabzusetzen. Ihr Einsatz ist heute in einigen Ländern (unter anderem Schweiz) verboten.
Phosphate werden auch als Kunstdünger eingesetzt.
Biologische Bedeutung
Die Folge des Einsatzes in Waschmitteln ist ein größeres Nährstoffangebot in Gewässern. Daraus resultiert ein verstärktes Algenwachstum, was zum Umkippen eines Gewässers führen kann.
Kaliumphosphat ist in der Homöopathie als Nervenmittel bekannt.
Quellen
Wikimedia Foundation.